비만 약물요법: 현재와 가까운 미래
Pharmacotherapy in obesity: the current state and the near future
Article information
Trans Abstract
Background
In Korea, the prevalence of obesity, morbid obesity with serious complications, and childhood obesity are rapidly increasing. To control the obesity pandemic, both prevention and treatment are essential strategic targets. While lifestyle modification is fundamental in obesity treatment, due to the complex appetite-controlling system in the body and the rapidly Westernizing environment, more effective treatment tools are required.
Current Concepts
There are 4 types of drugs that have been approved for the treatment of obesity in Korea. They are (1) appetite suppressants for short-term therapy, (2) dietary fat absorption inhibitors, (3) glucagon-like peptide-1 (GLP-1) receptor agonists, and (4) fixed-dose combination drugs for appetite control. However, a large amount of weight reduction cannot be achieved with these drugs. The greatest amount of weight reduction of approximately 11% has been reported for phentermine/topiramate combination treatment. Recently, peptide agents have been under development and 2 of these agents, semaglutide, a second generation GLP-1 receptor agonist, and tirzepatide, a glucose-dependent insulinotropic polypeptide/GLP-1 receptor dual agonist, are expected to be available in the near future.
Discussion and Conclusion
Both semaglutide and tirzepatide are more effective than currently available anti-obesity drugs. Semaglutide and tirzepatide reduced the body weight of people with obesity without diabetes by 14.9% and 20.9%, respectively. However, because of the mechanism of GLP-1 receptor agonism, gastrointestinal adverse events, including nausea, diarrhea, vomiting, and abdominal pain, were problematic in many patients, although these adverse events were generally acceptable. Both drugs will be excellent options for obesity treatment in the near future.
서론
최근 20년 정도의 기간 동안 우리나라의 비만 유병률은 빠르게 늘어났고, 고도 비만과 심각한 합병증을 동반한 비만이 현재 급속도로 증가하고 있다. 뿐만 아니라 소아 비만 역시 빠르게 늘어나고 있어서 미래에도 상당 기간 우리나라 인구의 비만화는 빠르게 진행될 것이다. 따라서 비만의 예방과 더불어, 이미 비만해진 사람들과 비만으로 인한 합병증을 동반한 사람들에 대한 비만치료의 중요성도 매우 높아졌다.
인간의 섭식 행위는, 인간의 의식 수준에서 결정되기보다는, 많은 호르몬과 신경전달물질이 관여하는 내재된 섭식 조절 시스템에 의해 결정되는데, 이 시스템은 주로 시상하부와 뇌간에 존재하며, 서로 긴밀하게 연결된 항상성 기전(homeostatic mechanism)과 쾌락 기전(hedonic mechanism)으로 구성되어 있다[1,2]. 이를 간략하게 설명하자면, 항상성 기전은 체내에 존재하는 에너지 수준을 파악하여 배고픔과 배부름 신호를 조절하고, 쾌락 기전은 이전에 먹었던 음식에 대한 맛과 구성 성분에 대한 기억을 통해 더 맛있고 더 열량이 높으며 영양가가 높은 음식을 선호하게 한다. 현재는 과거에 비해 맛있고, 칼로리가 높고, 고도로 정제 되었으면서도 값이 싼 음식이 증가하였으며, 섭식 횟수와 1 회 음식 제공량이 모두 증가하였다. 인간의 섭식 조절 시스템은 기아에 대비하여 근본적으로 음식이 생겼을 때 많이 먹는 쪽으로 기울어져 있는데, 현대 사회는 달콤하거나 기름진 음식이 충분히 제공되어 이의 반복적인 섭취를 통해 배부름 신호가 약해지고 쾌락 기전에 의한 고당 고지방 음식 선호 행위가 강화되어 체내의 섭식 행위 조절 기전의 균형이 비만 쪽으로 기울어져 버린다. 이 때문에, 의도적인 식사와 활동량에 대한 습관 조절을 통한 체중감량 혹은 비만 예방만으로는 비만을 조절하기에 충분하지 않으며, 이보다 더욱 효과적인 생물학적 비만치료법이 필요하다.
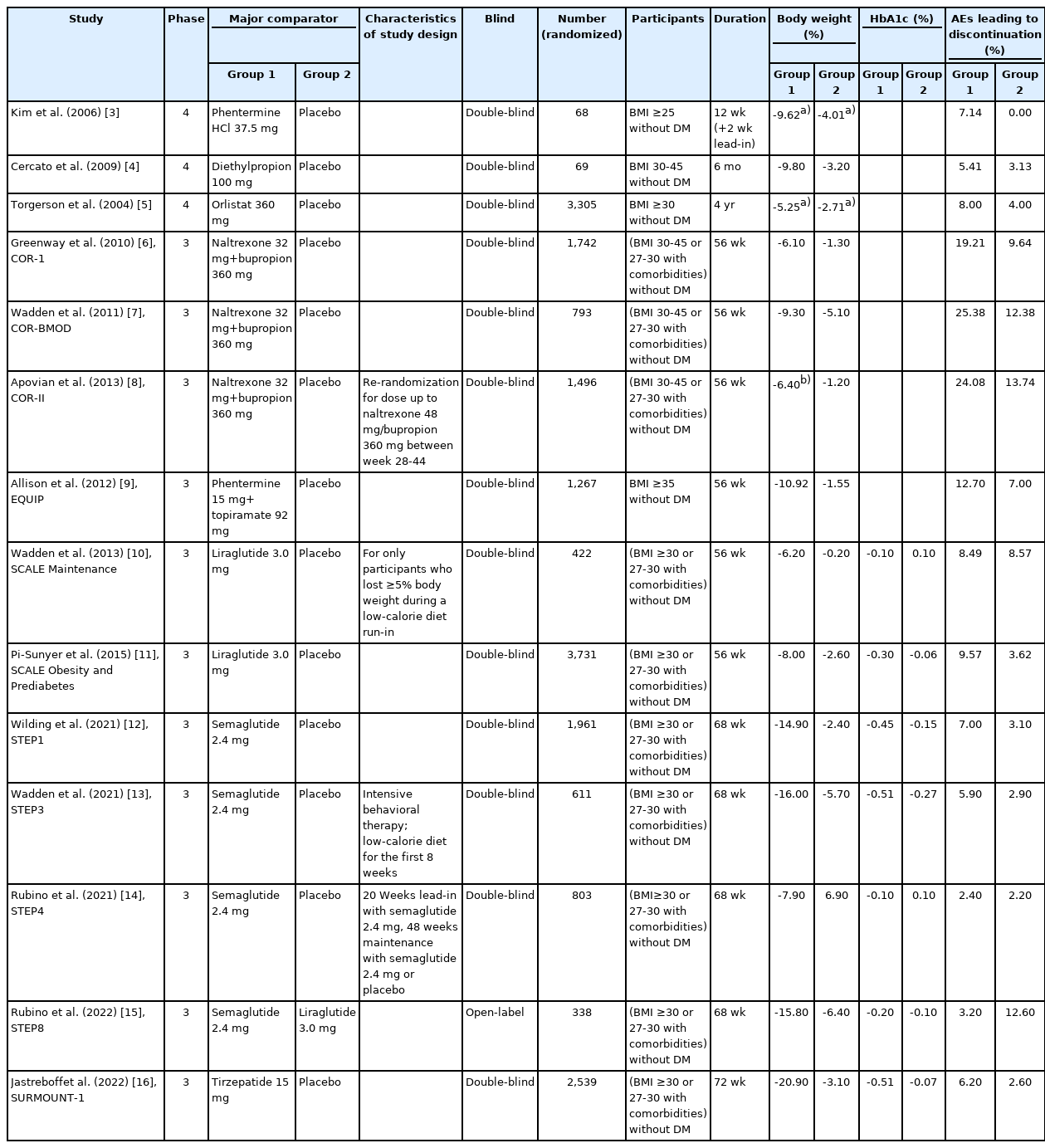
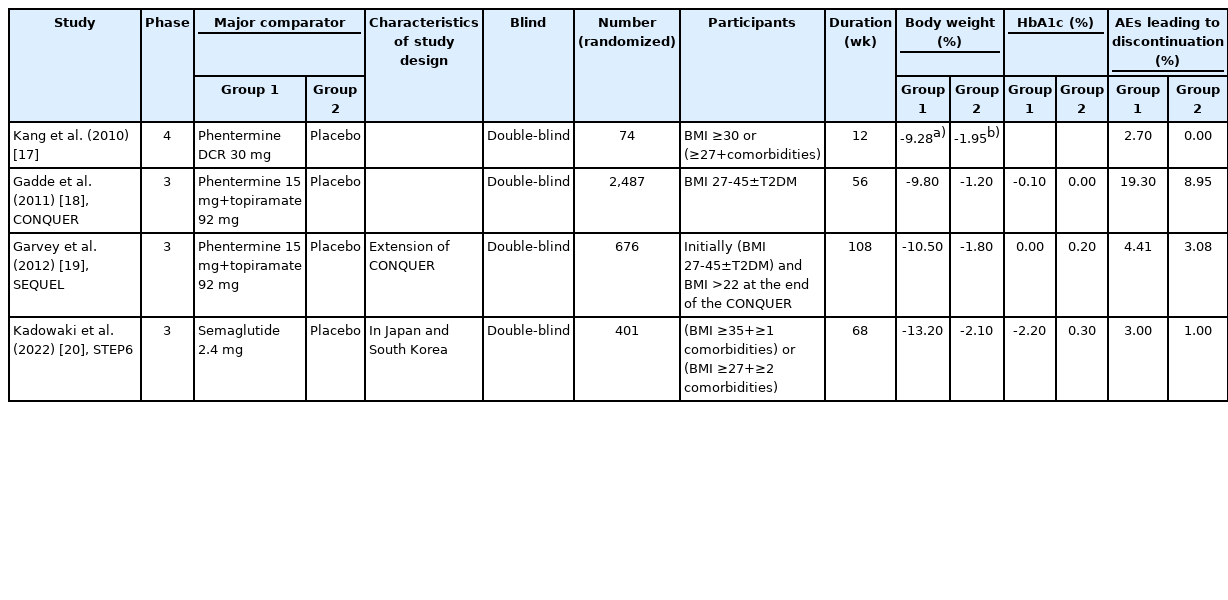
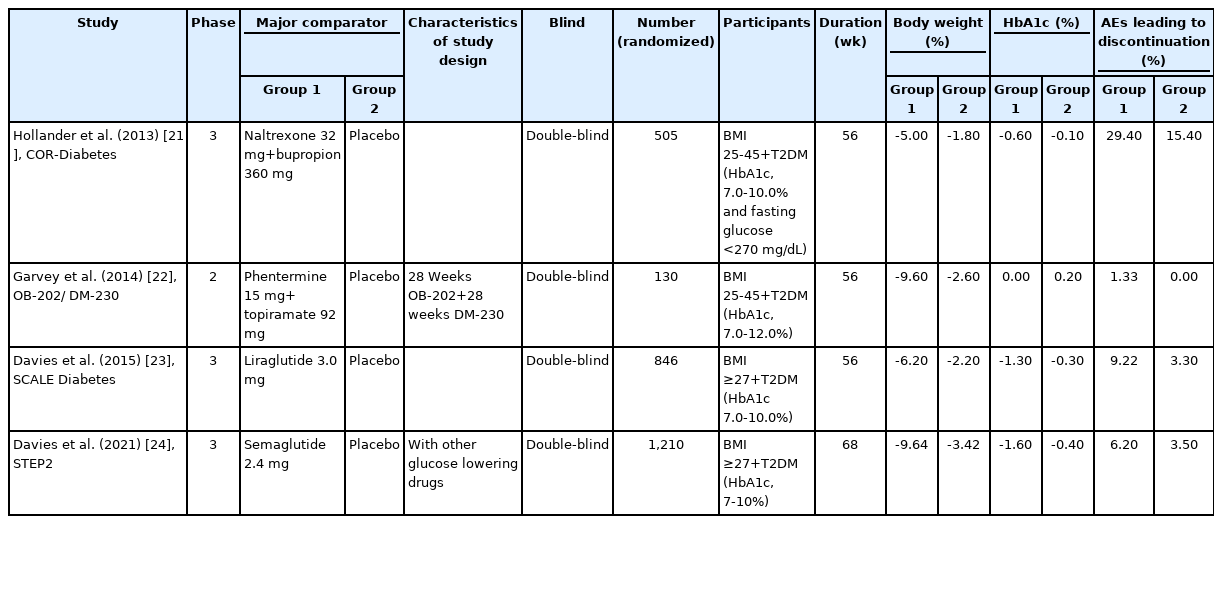
비만치료에서 약물 치료는 수술 치료에 비해 가역적이고 심각한 부작용이 적으며 실행이 쉽기 때문에 많은 비만인들에게 적용되어 왔다. 그간 여러 가지 비만치료 약물이 개발되어 사용된 바 있고, 현재 여러 가지 비만치료 약물들이 계속 개발되고 있으며, 새로 개발되는 약제들의 체중감량 성적이 빠르게 향상되고 있다. 이 논문에서는 2022년 현재 사용할 수 있는 비만치료 약물과 최근 여러 3상 임상연구 결과를 통해 조만간 임상에서 사용 가능할 차세대 비만 약물의 작용 기전과 유효성 및 안전성을 소개하고자 한다. 이 논문에서 서술된 약물들을 이용한 최근 20년 간의 주요 임상연구들은 대상자별로 나누어 Tables 1-3에 정리하였다[3-24].
펜터민 및 그 외의 단기 사용 식욕억제제
1. 펜터민
1) 개요
펜터민(phentermine) 이전의 초기 교감신경작용제로 암페타민(amphetamine)이 있었는데, 암페타민은 심혈관계 부작용, 뇌출혈 위험 증가, 남용 위험성 등으로 비만치료에 더는 사용되지 않지만, 이와 유사한 구조나 기전의 약물들이 아직까지 비만치료에 많이 이용되고 있다. 펜터민은 시상하부 식욕 조절 중추의 신경말단에서 노르에피네프린(norepinephrine)의 분비를 증가시키는 교감신경작용제로서, 강한 식욕억제를 유도하여 비만치료에 매우 효과적이다. 펜터민은 1959년에 미국 식품의약국(US Food and Drug Administration, FDA)에서 비만치료제로 승인을 받고, 현재까지도 미국에서 가장 널리 사용되고 있는 약물이다.
2) 효과
체질량지수(body mass index, BMI) 25 kg/m2 의 비만인을 대상으로 국내에서 12주간 진행된 무작위 대조군 연구에서, 대조군의 4.01% 체중감량에 비하여, 펜터민 HCl 37.5 mg 투약군에서는 9.62%의 체중감량 효과를 보여주었다(Table 1) [3]. 또, BMI 30 kg/m2 이상 또는 27 kg/ m2 이상이면서 당뇨병을 포함한 동반질환을 가진 비만인을 대상으로 12주간 진행한 무작위 대조군 연구에서 펜터민 diffusion-controlled release 30 mg 투여군에서 9.28%의 우수한 체중 감소를 보였다(Table 2) [17]. 10,000명 이상의 진료 보험 기록을 바탕으로 펜터민의 사용과 관련한 3년간의 관찰연구에서는 심혈관질환 사망 위험도가 증가하지 않음을 보여주었으나[25], 펜터민/토피라메이트(topiramate) 복합제의 연구 외 펜터민 단독 장기 사용의 안전성에 대한 증거가 부족하다. 따라서 이 약물은 식품의약품안전처의 승인에 따라 단기간 사용이 바람직하며, 사용 시 심혈관 관련 부작용 및 의존성에 대한 주의가 필요하다.
3) 부작용
펜터민은 필로폰으로 알려져 있는 메트암페타민(methamphetamine) 계열의 약물이라서 중추신경계 자극과 관련한 부작용들이 나타날 수 있고, 환자들은 구갈, 어지럼증, 두통, 손떨림, 구역, 변비 등을 흔히 호소한다. 부작용으로 수면장애가 잘 생길 수 있어서 약제 복용 시간을 오전으로 하는 것이 도움이 될 수 있다. 과거에 매우 우수한 체중감량 효과로 사용되던 펜터민/펜플루라민(fenfluramine) 복합제가 판막성 심장질환과 원발성 폐동맥 고혈압의 발생 위험 증가로 인해 시장에서 퇴출된 점을 미루어 보아, 펜터민 단독 사용 시에도 원발성 폐동맥 고혈압과 역류성 판막심장병 등의 심혈관계 문제에 대한 주의를 필요로 한다.
4) 금기
중등증-중증 고혈압이나 심혈관계 질환이 있는 경우 펜터민의 사용으로 기존 질환이 악화될 수 있다. 진전된 동맥경 화증, 폐동맥 고혈압 환자, 갑상샘 기능 항진증 환자에서 사용하지 않도록 하고, 녹내장 환자, 정신적으로 매우 불안하거나 흥분상태에 있는 환자, 약물남용의 병력이 있는 환자, monoamine oxidase (MAO) 억제제를 복용 중이거나 또는 복용 후 14일이 경과하지 않은 환자, 다른 식욕억제제를 복용하고 있는 환자에서도 금기이며, 16세 이하의 소아, 임산부 또는 임신하고 있을 가능성이 있는 여성에서도 사용하면 안된다.
5) 특이사항
펜터민은 중추신경 활성호르몬의 분비를 강력하게 촉진하기 때문에 의존 발생 위험이 높아 의료용 마약류로 분류되어 있다. 펜터민은 미국의 약물관리법(Controlled Substances Act, CSA)에 따라 schedule IV로 관리하고 있으며, 국내에서도 의료용 마약류 식욕억제제 안전사용 기준에 따라 허가용량 내 최소 유효 용량을 사용하되 개인별로 용량을 조정하여 한번에 4주 이내 처방을 하고, 추가 처방이 필요할 시에 총 처방기간을 3개월을 넘기지 않도록 하고 있다.
2. 펜터민 외의 단기 사용 식욕억제제
펜터민과 유사한 기전으로 작용하여 식욕을 억제하는 약물로는 펜디메트라진(phendimetrazine), 디에틸프로피온 (diethylpropion), 마진돌(mazindol)이 있다. 이 약물들은 모두 펜터민과 마찬가지로 단기간 처방이 허가된 식욕억제제로서, 펜디메트라진과 디에틸프로피온은 식욕 조절 중추에서 노르에피네프린의 분비를 증가시키고, 마진돌은 노르에피네프린의 재흡수를 억제한다. 펜터민과 마찬가지로 이 약물들은 장기간 사용 가능한 다른 약물들에 비하여 가격이 저렴하고 비교적 체중감량 효과가 좋아서 여전히 많이 처방되고 있다. 부작용과 금기도 펜터민과 유사하여, 심혈관계 부작용에 대한 주의가 필요하고, 의존성 발생의 위험을 고려하여야 한다.
펜디메트라진의 경우, 노르에피네프린과 도파민의 유리를 함께 촉진시키므로, 타 식욕억제제에 비해 의존성 발생 가능성이 좀 더 높아서, CSA schedule III로 관리하고 있다. 통상 투여 방법은 펜디메트라진 35 mg를 식사 1시간 전 하루 2-3회 투여하는 것이다.
디에틸프로피온은 보통 25 mg를 하루 3회 식사 1시간 전에 투여하며, 하루 최대 용량은 75 mg이다. 디에틸프로피온의 효과를 보여준 무작위 대조군 연구가 있는데, 이 연구에서는 비만인 대상자들(BMI, 30-45 kg/m2)에게 통상 우리 나라에서 승인되어 사용되는 용량보다 고용량인 디에틸프로피온 50 mg 하루 2회 6개월간 투여한 결과, 평균 9.8%의 체중감량의 효과를 보여주었다[4].
마진돌의 경우는 MAO를 억제하여 작용하므로, 다른 MAO 억제제와 함께 투여하면 안된다. 통상 마진돌 1 mg을 하루 1-3회 투여한다. 마진돌은 최근 소아청소년 주의력결핍과다활동장애 환자에게 2상 임상이 진행되기도 하였는데, 이는 주의력결핍과다활동장애의 치료에서 카테콜라민 재흡수를 막거나 방출하는 약제들이 새롭게 주목을 받은 것과 관련 있다[26].
오르리스타트
1. 개요
오르리스타트는 현재 사용되는 다른 비만 약물들과 달리, 식욕 조절의 기능은 없이 지방흡수를 억제하여 체중을 감량한다. 이 약제는 리파제(lipase)의 작용을 억제하여 장에서 중성지방이 지방산으로 분해되는 것을 차단함으로써, 음식으로 섭취한 지방의 약 30% 정도가 흡수되지 않고 배출되게 한다. 오르리스타트는 1999년에 FDA의 승인을 받았으며, 현재 120 mg, 60 mg 두 가지의 용량으로 처방이 가능하다. 통상 120 mg 하루 3회 식사와 함께 또는 식사 후에 투여한다.
2. 효과
오르리스타트는 Xenical in the Prevention of Diabetes in Obese Subjects (XENDOS) 연구를 통해 4년간 평균 5.8 kg의 유의한 체중감량 효과와 안전성을 증명하였으며, 비만인에서 2형 당뇨병의 발생 위험도를 37.3% 감소시키는 당뇨병 예방 효과를 보여주었다[5].
3. 부작용
오르리스타트는 극히 일부만이 체내에 흡수되기 때문에 전신적으로 발생하는 심각한 부작용은 드물지만, 약의 작용 기전과 관련하여 지방변, 대변실금, 복부팽만, 방귀, 장불편감 등의 위장관계 부작용이 흔하게 나타나므로 처음 복용하는 환자의 경우에는 사전에 이와 관련하여 자세한 설명이 필요하다. 이런 소화기계 부작용은 치료 초기에 주로 나타나고, 복용을 지속하면서 줄어드는 경향을 보인다. 이외에 드문 부작용으로 간 손상과 췌장염이 보고된 바 있으므로 중증 간기능 장애가 있다면 약물 투여는 권고되지 않으며, 소변으로 수산(oxalate)의 배설이 증가되어 신장 결석이 생길 수 있다. 대체적으로 타 약제와의 상호작용은 적은 편이지만, 비타민K의 흡수가 감소될 수 있으므로 와파린 투여 환자에서는 혈액응고와 관련한 주의 깊은 관찰이 필요하고[27], cyclosporin이나 amiodarone의 효과를 감소시킬 수 있다. 또한 지용성 비타민의 흡수가 감소될 수 있으므로, 지용성 비타민의 보충을 고려해볼 수 있다.
4. 금기
임산부, 수유부 및 만성흡수장애증후군이나 담즙 분비 장애 환자에서는 금기이며, 이 약의 성분에 과민반응이 있는 환자에서는 사용해서는 안된다.
5. 특이사항
오르리스타트는 12세 이상 소아청소년에게도 처방 가능하도록 승인 받은 약물로서, 체중감량 효과는 식욕 조절 중추에 작용하는 다른 비만 약물에 비하여 다소 부족할 수 있으나, 그 때문에 오히려 중추신경계와 관련된 부작용에서는 상대적으로 안전하게 장기간 사용할 수 있는 약물이다.
날트렉손/부프로피온 복합제
1. 개요
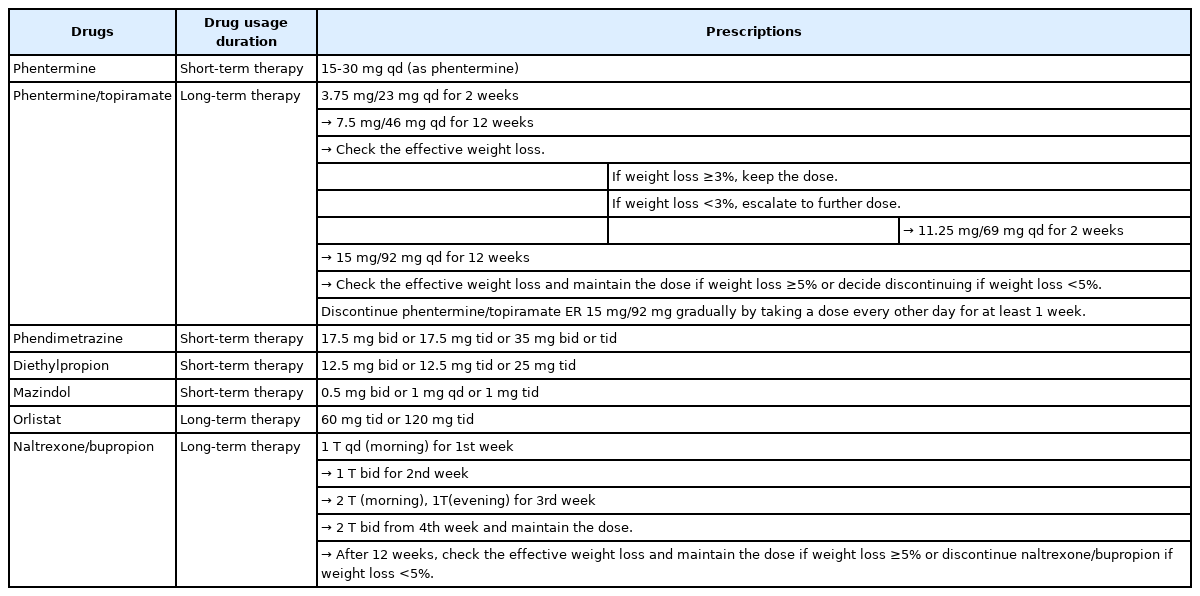
부프로피온(bupropion)은 도파민/노르에피네프린의 재흡수억제제로서, 우울증과 니코틴중독에 사용되고 있으며, proopiomelanocortin (POMC)/cocaine- and amphetamine-regulated transcript (CART) 뉴런을 자극하여 식욕억제의 효과를 나타낸다. 이때 POMC/CART 뉴런은 스스로 뮤 아편양 수용체를 자극하여 음성 피드백 작용을 나타내어 식욕억제 효과가 감소하는데, 알코올 및 마약 중독 치료로 사용되는 날트렉손(naltrexone)이 이러한 뮤 아편양 수용체를 억제하여 POMC/CART 뉴런의 자극을 증가시킴으로써, 부프로피온의 식욕억제 효과를 강화한다. 날트렉손/부프로피온 복합제(naltrexone/bupropion, nal/bup)는 이러한 기전으로 식욕을 조절해줄 뿐 아니라 배고픔과 무관하게 음식을 섭취하게 되는 일종의 쾌락적 음식 중독인 식탐을 함께 통제하여 유의한 체중 감소 효과를 보인다. Nal/ bup은 미국(FDA)과 유럽(European Medicines Agency) 양쪽에서 모두 허가 받았다. Nal/bup 투여 방법은 Table 4와 같다.
2. 효과
Nal/bup의 임상연구는 CONTRAVE Obesity Research (COR) 연구 시리즈가 대표적이며, 그 결과는 Tables 1, 3 과 같다. COR I 연구에서 nal/bup (32/360 mg)을 56주간 복용했을 때 6.1%의 체중감량을 보였으며[6], nal/bup를 복용하면서 강한 행동수정요법을 함께 병행한 COR-BMOD 연구에서는 56주간 연구를 마쳤을 때 9.3%의 체중감량 성적을 보였다[7]. Nal/bup는 체중감량의 효과 외에도 COR Diabetes 연구를 통해 2형 당뇨병 환자의 당화혈색소 감소 효과도 보여주었고[21], COR 연구들을 통해 혈중 지질 개선 결과도 확인하였다.
3. 부작용
Nal/bup를 복용하였을 때 가장 흔하게 나타나는 부작용은 위장관계 증상이 대표적인데, 오심, 구토, 변비가 주로 나타나고, 이외에도 두통, 어지러움, 수면장애를 호소한다[6,9]. 특히 오심과 구토의 경우에 시간이 지나면 호전이 되는 경향을 보이기는 하지만, 약물을 중단하게 되는 주요 원인이기도 한데, 약물 적응기간을 지켜서 단계적으로 증량해 나가는 것이 이러한 부작용을 줄이는 데에 도움이 된다. Nal/bup 복용 시에 심박동수가 증가되거나 복약 초기에 혈압 증가가 있을 수 있으므로, 처방 시 이에 대해 주의를 기울여야 한다. 유럽 집행위원회의 검토에서 nal/bup의 사용 중 자살경향성 사례가 보고되면서 이에 대한 경고문구가 추가되었고, 시판 후 조사에서 날트렉손과 연관될 것으로 생각되는 간효소 수치 상승의 사례들이 있어서 간 손상에 대한 주의가 필요하다[28]. Nal/bup는 시판 후 경험에서 의식소실의 보고가 있어서 이 약물 치료 중(치료 시작 또는 적정단계)에 운전을 하거나 기계를 다룰 때 유의해야 한다. 또, 이러한 의식소실이나 졸림, 발작을 경험한 환자는 운전 또는 기계조작을 피해야 하고 치료 중단을 고려해야 한다.
4. 금기
이 약물에 과민반응을 보이는 경우 금기이다. Nal/bup는 혈압 상승과 심박동수 증가를 보일 수 있으므로 조절되지 않는 고혈압 환자, MAO 억제제 투여중인 경우에 금기이고, 경련 발작과 관련하여 부프로피온은 발작의 역치를 낮출 수 있으므로 과거 경련의 병력이 있는 경우, 발작의 위험을 증가시킬 수 있는 중추신경계 종양 환자, 두부 외상의 경험이 있는 경우, 알코올이나 벤조디아제핀계, 항간질약 등의 약물 복용을 갑자기 중단한 환자, 아편류 의존이나 금단증상이 있는 환자에서도 약물을 사용하지 말아야 한다. 특히 nal/bup 는 75세 이상의 고령에서는 사용하지 않도록 하고, 중증 간장애, 간부전, 말기신질환 환자에서도 금기이다. 클로피도그렐(clopidogrel), 티클로피딘과 같은 CYP2B6 억제제를 복용 중이라면 nal/bup는 하루 2정 이상 초과하지 않아야 하고, 항정신병 약물이나 항우울제, 테오필린(theophylline) 등 약물 상호작용으로 경련 발작의 역치를 낮출 수 있는 약물과 병용 시에는 매우 주의를 기울여야 하며, 양극성장애 환자, 대식증 또는 신경성식욕부진 환자에서도 금기이다.
5. 특이사항
Nal/bup는 비향정신성 의약품으로 분류되는 약물로, 의존성이나 오남용의 우려가 없이 장기간 처방이 가능하지만, 심혈관계 안전성을 증명하기 위해 진행되던 연구가 중단됨에 따라 심혈관 안전성은 입증되지 않은 상태이다[29].
펜터민/토피라메이트서방정 복합제
1. 개요
펜터민은 비만치료에 널리 사용되고 있는 식욕억제제이고, 토피라메이트는 뇌전증 및 편두통에 사용되는 약제이다. 토피라메이트의 식욕억제 기전은 불확실하지만, GABA 수용체에 작용하여 식욕을 억제하고 포만감 증가를 유발하는 것으로 추정되고 있다. 이 두 약물의 복합제인 펜터민/토피라메이트 복합제(phentermine/topiramate, phen/top)는 각각 약제의 기존 사용 용량에 비하여 적은 용량 조합으로도 체중감량에 우수한 효과를 보여주어, 2012년 FDA의 승인을 받았고 국내에서는 2019년 7월에 식품의약품안전처 허가를 받았다. 비만약으로 펜터민은 주로 30 mg까지 사용하고, 토피라메이트는 항간질약으로 400 mg까지 사용을 할 수 있는데, phen/top는 용량별로 3.75/23 mg, 7.5/46 mg, 11.25/69 mg, 15/92 mg의 네 가지 제형이 있으며, 최대 용량인 15/92 mg의 경우에도 각각의 용량이 원래 단독 사용 용량보다 훨씬 적으므로 부작용도 개별 약제 투여 시에 비해 적은 것으로 생각된다. Phen/top는 저용량부터 시작하여 순서대로 증량을 하도록 하며 사용방법은 Table 4와 같다. 3.75/23 mg와 11.25/69 mg은 증량을 위한 징검다리 용량이며, 유지용량은 7.5/46 mg와 15/92 mg이다. 유지용량으로 12주 유지하여, 최초 투여 시점부터 5% 이상 체중감량이 되지 않은 경우는 증량 혹은 복용 중단을 고려하고, 체중감량 효과가 이 이상 충분하면 유지용량으로 지속 투여한다.
2. 효과
Phen/top는 현재 국내에서 처방 가능한 비만치료 약물들 중에서 체중감량 효과가 가장 우수하다[30], 당뇨병이 없는 BMI 35 kg/m2 이상인 비만인에서 56주간 phen/ top 5/92 mg을 복용한 그룹에서 10.92%의 체중감량 효과를 보였다(Table 1) [8]. 미국 18-70세의 2,487명이 참여한 CONQUER 연구는 BMI는 27-45 kg/m2, 2개 이상의 대사성 동반질환(고혈압, 고지혈증, 당뇨병 또는 전단계 당뇨병, 비만)을 가지고 있는 환자들을 대상으로 하였다(Table 2). 이 연구의 56주의 연구 종료 시점에서 평균 체중감량 결과는 위약군, phen/top 7.5/46 mg군, phen/top 15/92 mg군에서 각각 -1.4 kg, -8.1 kg, -10.2 kg이었다. Phen/top 15.0/92.0 mg군의 70%, 7.5/46 mg군의 62%에서 5% 이상 체중감량 결과를 보여주었고, 10% 이상 체중감량을 보인 비율도 15.0/92.0 mg 복용군에서 48%나 되었다[18]. 이처럼 우수한 체중감량 효과를 보여준 CONQUER 연구를 더 연장하여 2년까지 진행한 SEQUEL 연구결과에서도 체중감량 효과가 유지되는 결과를 보였고, 2형 당뇨병으로의 진행을 유의하게 줄여주었다(Table 2) [19]. Phen/top의 여러 임상연구들에서는 체중감량뿐만 아니라 혈압, 혈당, 지질 수치의 개선 효과도 보여주었다[8,18,19].
3. 부작용
이 약은 펜터민과 토피라메이트 두 약의 복합제이므로 두 가지 약물의 부작용이 모두 나타날 수 있는데, 흔한 부작용으로는 감각이상, 구갈, 어지러움, 미각이상, 불면증, 두통, 변비 구역, 설사 등이 있으며, 이런 부작용은 용량의존적으로 발생이 증가한다. 약을 복용하는 중에 우울, 불안 등의 기분장애가 증가할 수 있으므로 이러한 증상이 발생하는지 관찰하여야 하고, 특히 자살사고, 자살행동이 있다면 약물을 즉시 중단하여야 하며, 집중력, 주의력 저하 등 인지기능 관련 문제가 발생할 수 있으므로 주의가 필요하다. 그리고 토피라메이트가 탄산탈수효소(carbonic anhydrase) 의 억제 작용이 있어서 이와 관련된 녹내장, 혈청 중탄산염 (bicarbonate) 농도 감소 및 대사성 산증, 저칼륨혈증, 요로 결석 등의 위험이 증가한다. 복용 중에 관련 증상이나 소견을 살펴보아야 하고, 만약 이런 부작용이 발생하였을 시에는 약물 투여를 중단하도록 한다. 또한 이 약물은 다른 탄산 탈수효소억제제(zonisamide, acetazolamide 등)와 함께 사용하지 않아야 하고, 이뇨제와 동시 사용 시에 조심하여야 한다.
4. 금기
Phen/top의 경우, 펜터민의 교감신경 활성화와 관련하여 중등도-중증 고혈압, 진전된 동맥경화증, 폐동맥 고혈압 등의 중한 심혈관계 문제가 있는 경우 사용해서는 안되고, 자살 병력이 있거나 정신적으로 불안한 환자, 약물 남용 병력이 있는 환자, 녹내장, 갑상샘 항진증의 경우 등에서도 금기이며, MAO 억제제와 병용하여서는 안된다. 또, 태아의 구개열 위험이 증가되므로[31], 임신가능성이 있는 여성에서는 반드시 약물 복용 전, 복용 중에 임신검사를 시행하도록 한다. 중등도의 만성신부전, 경도-중등도의 간기능 장애에 서는 1일 7.5/46 mg 이상 용량을 초과하지 않도록 하고, 중증 만성신부전과 간기능 장애에서는 이 약물을 사용하지 않도록 한다.
5. 특이사항
Phen/top는 청소년을 대상으로 한 4상 연구를 바탕으로, 2022년 6월 FDA에서 12세 이상 청소년까지 적응증 확대를 승인 받았다. Phen/top 15/92 mg의 유지요법을 시행하다가, 약물을 중단하려고 할 때에는 갑작스러운 복용 중단이 발작을 일으킬 위험이 있기 때문에 치료를 완전히 중단하기 적어도 1주일 전부터 하루걸러 한 번씩 약을 복용하여 점차적으로 phen/top를 중단하도록 한다.
글루카곤유사펩타이드-1 수용체 작용제, 리라글루티드와 세마글루티드
1. 개요
과거에 승인 받았던 비만치료 약물들에 비해 최근 10년 안에 3상 연구 결과가 발표된 비만 약물들의 특징은, 인간 및 다른 포유류의 체내에서 만들어지고 분비되는 인크레틴 (incretin) 및 기타 장호르몬을 기반으로 만들어진 펩타이드 제제라는 점이다. 펩타이드 비만치료 약물은 체내에 존재하는 여러 가지 펩타이드 수용체를 자극하거나 길항함으로써 체중과 에너지 대사에 영향을 미치기 때문에, 우수한 치료 효과에 비해 부작용을 최소화한 제제가 가능한 반면, 소화 효소에 대한 안정성이 떨어지기 때문에 경구 투여가 쉽지 않다는 특징이 있다. 최근의 펩타이드 비만치료제의 목표 수용체는 글루카곤 글루카곤유사펩타이드-1 (glucagon-like peptide-1, GLP-1), glucose-dependent insulinotropic polypeptide (GIP), 글루카곤, 아밀린 등의 수용체이다.
GLP-1 수용체 작용제는 현재 비만과 당뇨병 치료에서 중요한 지위를 차지하고 있다. GLP-1은 음식 섭취에 반응하여 위장관에서 분비되는 호르몬인 인크레틴의 하나이며, 프로글루카곤 유전자(proglucagon gene)의 전사 후 처리과정을 통해 만들어지며, 원위부 회장과 대장에 존재하는 L세포 및 뇌간의 고립로핵(nucleus tractus solitarius)의 프로글루카곤 표현형 뉴런에서 분비된다[32]. GLP-1은 미주신경을 통하여 시상하부의 식욕 중추에 작용하며, 충분한 농도가 유지되는 경우에는 혈액 뇌 장벽을 통과하여 직접적으로 뇌의 여러 부위에 존재하는 GLP-1 결합 부위에 부착하여 생리 작용을 나타낸다[1]. GLP-1이 식욕을 억제하는 기전은, 첫째로 시상하부에 존재하는 POMC/CART 뉴런을 자극하여 직접적으로 식욕을 억제하는 것이고, 둘째로 GABA 신호를 통해 간접적으로 neuropeptide Y/agouti-related peptide 뉴런을 억제하여 식욕 촉진을 저해함이며, 셋째로 중뇌변연 (mesolimbic) 도파민 보상 시스템을 억제하는 것이다[1]. 중추에서의 항상성 기전과 쾌락 보상 기전에 의한 체중 조절 시스템에 대한 내용은 기존의 문헌에 설명되어 있다[1].
인간 고유 GLP-1은 반감기가 매우 짧아서 실제 임상에서 사용할 수 없기 때문에, 임상적으로 유용한 GLP-1 수용체 작용제를 개발하기 위해서는 이의 반감기를 획기적으로 늘여야 했다. GLP-1 수용체 작용제 중 체중감량 목적으로 승인을 받은 리라글루티드(liraglutide)와 세마글루티드 (semaglutide)는 반감기를 증가시키기 위해 알부민과의 가역적 결합을 이용했는데, 그 방법은 인간 고유 GLP-1을 근본 구조로 하면서 여기에 linker를 통해 지방산과 연결하여 부착된 지방산을 통해 알부민과 결합을 유도하는 것이었다[33].
2022년 7월 현재 우리나라에서의 식품의약품안전처 허가 상황은, 리라글루티드는 당뇨병 치료 및 비만치료에 대해 승인을 받은 반면, 세마글루티드는 당뇨병 치료에 대해서만 승인을 받았고 비만치료에 대해서는 승인 검토 단계에 있다. 이 두 가지 약제의 효과를 나타내는 펩타이드 근간은 인간 고유 GLP-1과 매우 유사하기 때문에 이 두 약제의 작용 기전과 임상적인 효과, 발현되는 부작용 종류는 유사하다. 그러나 이 두 약제에 사용된 linker와 지방산의 차이 및 세마글루티드에서 추가적으로 변경된 아미노산에 의해, 이 둘 사이에 유효성, 지속 시간, 부작용의 강도 및 투여 방법에서 차이가 있다. 이 두 약제의 특성은 Table 5에 비교되어 있다.
2. 효과
리라글루티드와 세마글루티드의 주요 임상연구 결과는 대상자별로 Tables 1, 3에 정리한 바와 같다. 체중감량 성적과 혈당 개선 효과는 리라글루티드에 비해 세마글루티드가 우수하다. 세마글루티드는 비당뇨병 비만인에서는 위약 대비 10% 이상의 추가 체중감량을 유도하여 총 15% 정도의 체중을 감량하며, 비만한 당뇨병 환자에서는 위약 대비 6%, 총 9% 이상의 체중을 감량한다.
리라글루티드와 세마글루티드는 증량을 하는 경우, 체중감량 성적은 뚜렷하게 향상되나, 2형 당뇨병 환자에서의 추가적인 혈당 개선 정도는 그에 비해 미미하여, SCALE Diabetes 연구에서 리라글루티드 1.8 mg군에 비해 3.0 mg군에서 당화혈색소는 0.2% 추가 감소했으며, STEP2 연구에서 세마글루티드 1.0 mg군에 비해 2.4 mg군에서 당화혈색소가 0.1% 추가 감소했을 뿐이다[23,24]. GLP-1의 혈당 강하 효과는 혈당 의존성 인슐린 분비 촉진에 의한 것이기 때문에, 충분한 혈당 강하가 이루어진 상태에서는 증량을 해도 추가적인 혈당 강하 효과가 미미하다.
세마글루티드가 리라글루티드에 비해 임상적으로 유용한 점은 리라글루티드는 하루 1회 피하주사해야 하는 반면, 세마글루티드는 피하주사의 경우 주 1회 투여하고, 하루 1 회 복용하는 경구 제제가 개발되어 있다는 것이다. 이 같은 차이의 주요한 이유는 두 약제에 사용된 지방산의 차이 때문이다. Table 5에서와 같이 세마글루티드는 리라글루티드와 다소 다른 linker를 사용했고 알부민에 부착되는 지방산의 길이가 더 길며 지방산의 구조가 카복실기가 두 개인 dicarboxylic acid 형태의 지방산을 가지고 있다. 지방산의 길이가 길어지면 알부민에 대한 결합력은 높아지나 수용체에 대한 효과는 떨어지는데, 세마글루타이드의 지방산은 카복실기가 하나 더 늘어남으로써 수용체에 대한 결합력도 증가하여 리라글루티드에 비해 약효는 약화시키지 않고 작용 시간을 길게 할 수 있었다[33].
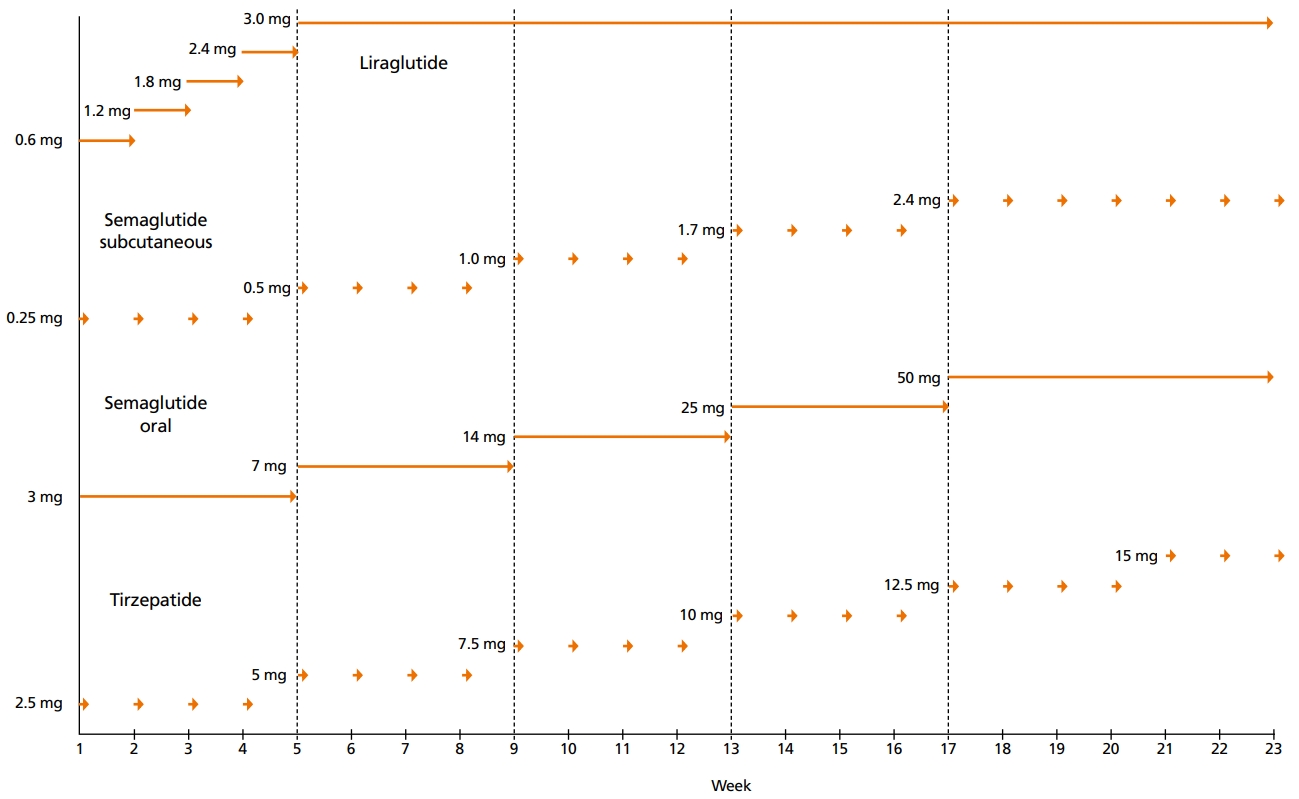
리라글루티드와 세마글루티드의 표준 투여 방법은 Figure 1과 같다. 경구용 세마글루티드는 약물의 일정한 흡수를 유지하기 위해 약제를 부수거나 씹지 말고 제형 그대로 아침 공복에 반 잔 이내의 소량을 물과 함께 삼켜서 복용하며, 복용 후 30분간 공복을 유지해야 한다.
3. 부작용
GLP-1 수용체 작용제들은 해당 계열 특유의 유사한 부작용을 보인다. 이 논문에서는 리라글루티드와 세마글루티드의 부작용을 기관계통별로 분류하여, 위장관계, 췌장, 심혈관계, 알레르기 및 피부, 저혈당에 대해서 기술하였다.
1) 위장관계
이들 두 약제에서 가장 흔하고 임상적으로 문제가 되는 부작용은 위장관계 부작용이다. 구역은 매우 흔하며, 설사, 변비, 구토가 그 뒤를 잇고, 소화불량, 복통 역시 비교적 자주 발생한다. 위장관계 부작용은 용량 의존적이며 발생 빈도가 매우 높지만, 개인차가 있고, 증량 속도가 빠르면 심해지며, 치료를 계속 유지하면 부작용 강도가 약해진다[11,14,34]. GLP-1 수용체 작용제는 위배출 속도를 느리게 하기 때문에 구역과 구토가 발생하는 것 같다. 이 외에도 GLP-1 수용체 작용제가 구역 중추를 자극함으로써 구역, 구토가 발생할 수 있다. GLP-1을 지속 투여하는 경우 GLP-1의 위배출 억제 작용은 빠르게 약해진다. 세마글루티드의 임상연구에서는 약제 투여에 의한 부작용에 대상자가 견디기 힘들어하는 경우에 표준 증량 방식보다 느리게 증량하거나 목표 용량보다 낮은 용량으로 유지하는 것을 허용하는데[12], 이와 같은 유연한 프로토콜이 세마글루티드 임상연구에서 약제 중단율이 비교적 낮은 원인일 수 있다. 이를 고려하여 실제 임상에서도 표준 투여 방법만 고수하지 말고, 각 환자의 임상 반응에 따라 증량 속도와 유지 용량을 개별화하는 것이 바람직하다.
2) 췌장
GLP-1 수용체 작용제는 췌장 랑게르한스섬에 작용하기 때문에 췌장염 유발에 대한 우려가 있다. 동물 실험 에서는 인크레틴 기반 약물 사용에 의해 급성 췌장염 발생이 증가했는데, 리라글루티드 및 세마글루티드의 대표적인 임상연구에서 급성 췌장염의 보고는 극히 드물며[11,12,14,16,20,23], 2형 당뇨병 환자에게 시행한 임상연구들의 메타분석에서도 GLP-1 수용체 작용제 투여에 따른 급성 췌장염 발생은 대조군가 차이가 없다. 하지만 리라글루티드와 세마글루티드 투여에 따라 아밀라제와 리파제는 다소 상승한다[11,14].
3) 심혈관계
심혈관계에 대해 GLP-1 수용체 작용제가 미치는 악영향은 심박수 증가이다. 하지만 리라글루티드와 세마글루티드에 의해 증가되는 심박수는 미미하며, 심혈관질환 고위험인 2형 당뇨병 환자에게 리라글루티드(LEADER 연구[35]), 피하주사 세마글루티드(SUSTAIN 6 연구[36]), 경구 세마글루티드(PIONEER 6 연구[37])를 투여하면서 새로운 심혈관계 사건 발생을 조사한 3개의 연구들을 보면, 피하주사 리라글 루티드와 세마글루티드의 경우 위약에 비해 심혈관계 사건 발생을 억제하였고, 경구 세마글루티드는 위약보다 심혈관계 사건 발생에 대해 열등하지 않으며 전체 사망과 심혈관질환으로 인한 사망은 억제하는 결과를 보여주어서, 리라글루티드와 세마글루티드는 심혈관계 전반에 대해서 위해에 비해 이득이 뚜렷하다.
4) 알레르기 및 피부
리라글루티드와 세마글루티드는 펩타이드이기 때문에 신체에 투여되어 항체 생성을 유도할 수 있고 알레르겐으로 작용할 수 있다. 2형 당뇨병 환자에 대한 리라글루티드의 6개 LEAD 연구에서 얻은 대상자의 혈액을 검사한 결과, 리라글루티드 1.2 mg군에서 8.7%, 1.8 mg군에서 8.3%의 항체 양성률을 보였는데, LEAD-6 연구의 엑세나티드 투여군에서 보인 61%의 항체 양성률에 비해서는 항리라글루티드 항체 생성률이 훨씬 낮았으며, 리라글루티드의 항체 양성군과 음성군을 비교했을 때 리라글루티드의 당화혈색소 강하 효과 에도 차이가 없었다[38]. 리라글루티드가 엑세나티드에 비해 인간 고유 GLP-1과의 상동성이 매우 높기 때문에 면역 원성(immunogenicity)이 낮아서 항체 생성률과 항체 역가가 낮고, 항체 생성이 용량 의존적이지 않으며, 항체 생성이 임상적으로 문제되지 않는 것으로 판단할 수 있다. 2형 당뇨병 환자에 대한 세마글루티드의 SUSTAIN 연구들에서 얻은 4,700여 명의 대상자 혈액을 검사한 결과, 1.4%의 대상자에서 항세마글루티드 항체가 검출되었으나, 항체 역가가 낮았고 지속적인 투여 이후 재측정한 결과에서는 0.3%의 대상자만 항체 양성을 보여서, 세마글루티드의 면역원성은 리라글루티드보다도 낮으며 항세마글루티드 항체는 대부분 일시적인 것으로 보인다[39].
하지만 시판 후 조사에 따르면 리라글루티드에 대한 아나 필락시스 반응, 가려움, 두드러기, 혈관 부종이 보고된 바있어서[34], 이 같은 반응이 나타나는 경우는 리라글루티드 중단을 고려해야 한다. 리라글루티드 투여 시, 주사 부위의 발적, 홍반, 가려움 등은 흔하지만 일시적인 경우가 많고 치료 중단으로 이어지는 경우는 많지 않다[34]. 세마글루티드 2.4 mg의 여러 STEP 연구들에서도, 알레르기 반응과 주사 부위 이상 반응의 빈도는 대조군에 비해 높지 않았다[12-14,20].
5) 저혈당
GLP-1 수용체 작용제는 혈당 개선 효과가 있어서 혈당 조절 능력이 떨어진 2형 당뇨병 환자에게 투여할 경우 저혈당 발현 위험성이 있으며, 실제로 2형 당뇨병 환자에게 리라글루티드나 세마글루티드를 투여하는 경우 저혈당이 발생할수 있지만, GLP-1의 혈당 강하 효과는 혈당 의존성 인슐린 분비 촉진에 의한 것이기 때문에, 이들 약제에 의한 심각한 저혈당 발생 사례는 드물다. 그러나 이들을 인슐린 및 설폰 요소제와 병용투여하는 경우에는 저혈당 발생이 증가한다. 리라글루티드나 세마글루티드를 설폰요소제와 함께 투여할때 저혈당 빈도가 증가하는 이유는 혈당이 높지 않은 상태에서도 설폰요소제가 GLP-1의 인슐린 분비 촉진 기능이 나타나게 하기 때문인 것 같다[40]. 이 때문에 2형 당뇨병이 있는 비만인을 대상으로 한 리라글루티드 3.0 mg과 세마글루티드 2.4 mg의 임상연구에서는 모두 저혈당 발생을 방지하기 위하여 설폰요소제를 복용하던 대상자들은 임상연구 시작시 설폰요소제의 용량을 절반으로 줄였다. 이들 임상연구에서 심각한 저혈당이 발생한 사례는 리라글루티드의 SCALE Diabetes 연구에서는 422명 중 3건, 세마글루티드의 STEP2 연구에서는 403명 중 1건이었다[23,24]. 당뇨병이 없는 비만인에서는 리라글루티드 투여군에서 위약군에 비해 저혈당 빈도가 높았으나 세마글루티드의 경우 위약군에 비해 저혈당 빈도가 높지 않았다[11,14].
GIP/GLP-1 이중 작용제 티제파티드
1. 개요
당뇨병, 고혈압, 이상지질혈증 등 여러 만성 질환에서 약물 치료 시 부작용은 줄이고 유효성을 높이기 위해 작용 기전이 다른 여러 약제들을 병합하여 사용하는 경우가 많다. 펩타이드 치료에서도 약제 병용 요법이 가능한데, 서로 다른 펩타이드를 동시에 투여하는 방법도 있지만, 최근에는 여러 수용체에 동시에 작용하는 펩타이드를 만들어서 한 가지 펩타이드로 다제 병용 요법과 같은 효과를 끌어내는 것도 가능하다. 비만과 당뇨병 치료에도 이와 같은 접근이 시도되고 있는 데, 비만과 당뇨병에 관련한 여러 수용체 중 GIP, 글루카곤 및 GLP-1 수용체는 서로 상동성이 있어서 이들에 대한 다중 작용제 개발이 용이하다. 최근 비만/비만전단계인 2형 당뇨병 환자와 당뇨병이 없는 비만 환자에서의 임상연구 결과들이 발표되고 있는 티제파티드(tirzepatide)가 GIP 수용체와 GLP-1 수용체에 동시에 작용하는 단일 펩타이드 이중 작용제이다.
GIP는 GLP-1과 함께 인크레틴으로 분류되며 혈당 및 에너지 대사의 조절에 중요한 펩타이드임에도 불구하고 수년 전까지는 비만과 당뇨병 치료제 개발에서 GLP-1에 비해 소외되어 있었다. 이 분야에서 GIP에 대한 관심이 적었던 이유와, 현재 GIP 수용체 작용제가 비만과 당뇨병 치료제로 개발되기까지의 과정은 기존의 문헌에 설명되어 있다[41]. 요약하자면, GIP 수용체 작용제 단독으로는 비만과 2형 당뇨병 치료에 적합하지 않은데, GIP가 지방 세포의 지방산과 당 흡수를 촉진하여 체지방을 증가시키는 반면, 글루카곤 및 아드레날린성 수용체 활성을 통한 체지방 분해는 억제하고, 2형 당뇨병 환자에서는 베타 세포의 GIP 수용체가 정상인에 비해 줄어들어 있어서 GIP 투여에 따른 인슐린 분비 증가 효과가 약하고, 고혈당 상태에서도 글루카곤 분비를 증가시키기 때문이다. GIP 수용체와 GLP-1 수용체를 동시에 자극하면, 중추 신경계에 존재하는 두 수용체의 식욕억제 효과가 상호 시너지를 형성하고, GLP-1 수용체 활성에 따른 고혈당 개선이 GIP 수용체의 베타 세포에 대한 효과를 강화하여 추가적인 혈당 개선을 유발할 수 있으며 GIP 수용체 활성에 따른 글루카곤 분비 촉진 효과는 GLP-1 수용체 활성에 의해 억제되기 때문에, 이는 비만과 2형 당뇨병 치료를 위한 좋은 전략이 될 수 있다.
티제파티드는 2022년 7월 현재 우리나라는 물론 다른 나라에서도 아직 비만이나 2형 당뇨병 치료에 대해서 사용 승인을 받지 못한 상태이나, 가까운 시일 안에 사용 허가를 받을 것으로 예상된다. 이 펩타이드는 GIP와 GLP-1 수용체에 대한 이중 작용제이기는 하지만, 두 수용체에 대한 친화성과 자극 효과는, GIP 수용체에 대해서는 체내 고유 GIP와 비슷한 강도의 친화성과 효과를 보이는 반면, GLP-1 수용체에는 고유 GLP-1에 비해 훨씬 낮는 결합력과 자극 효과를 보인다[42]. 이 때문에, 임상적인 효과를 높이기 위해 증량을 하는 경우 임상 효과 대비 구역, 구토와 같은 소화기계 부작 용을 상대적으로 약화시킬 수 있는 장점이 있다.
2. 효과
티제파티드의 체중감량 성적은 기존 비만 약제의 성적을 압도한다. 티제파티드의 주요 임상연구 결과는 Tables 1, 6에 정리한 바와 같다[16,43-47]. 티제파티드의 체중감량 성적은 당뇨병 유무에 관계없이 세마글루티드에 비해 우수해 보인다. 최근 발표된 SURMOUNT-1 연구[16]에 따르면 비당뇨병 비만인에서는 티제파티드 15 mg의 경우 위약 대비 18%, 총 21% 정도의 체중감량 성적을 보이며, 저용량인 5 mg에서도 총 15%의 체중감량 성적을 보였다. 티제파 티드 15 mg은 SURPASS-1 연구[46]에서 당뇨병이 있는 BMI 23 kg/m² 이상인 환자에서도 STEP2 연구(세마글루티드 2.4 mg군 경우 평균 100.5 kg)에 비해 낮은 초기 체중 (평균 85.4 kg)임에도 불구하고 위약 대비 10%, 총 11%의 체중감량 성적을 보였으며, 5 mg의 경우 7.9%의 체중감량 성적을 보였다.

Published phase 3 trials of tirzepatide for participants with overweight/obesity and type 2 diabetes mellitus
티제파티드의 2형 당뇨병 당화혈색소 개선 효과 역시 매우 우수하다. SURPASS-1 연구[46]에서 초기 당화혈색소 7.95%인 2형 당뇨병 환자에 티제파티드 투여 시 세 가지 용량 모두에서 당화혈색소를 2% 전후로 하강시키며 정상화시켰다. 증량에 따른 당화혈색소 강하 효과의 차이는 비교적 적었는데, 5, 10, 15 mg 투여군에서 당화혈색소 강하 정도는 각각 1.87%, 1.89%, 2.07%였다. 증량에 따른 당화혈색소 추가 하강이 적은 것은 리라글루티드 및 세마글루티드와 비슷하다. SURPASS-2 연구에 의하면 2형 당뇨병 치료 용량에서 티제파티드는 세마글루티드보다 혈당 강하 효과가 우수하여, 세마글루티드 1.0 mg 투여군, 티제파티드 5, 10, 15 mg군에서 당화혈색소 하강 성적은 각각 1.86%, 2.01%, 2.24%, 2.30%였다[44].
티제파티드는 세마글루티드와 유사하게 카복실기가 2개인 dicarboxylic acid 형태의 지방산을 통해 알부민과 결합하게 함으로써 반감기를 길게 만들었기 때문에 주 1회 피하 주사 투여가 가능하며, 세마글루티드의 지방산은 18개의 탄소를 함유하는 아실 사슬인 반면 티제파티드는 20개 탄소의 아실 사슬이다[48]. 티제파티드의 임상연구에서 사용한 표준 투여 방법은 Figure 1과 같다.
3. 부작용
티제파티드는 아직 시판 전 상태여서 부작용에 대한 충분한 경험은 없다. 임상연구에서 보고된 부작용으로는 구역, 설사, 변비, 구토, 복통, 트림 등 위장관계 부작용이 가장 많았고, 그 외 탈모, 어지러움, 주사부위 이상반응, 저혈당 등이 위약에 비해 뚜렷하게 많이 발생했다. 위장관계 부작용은 비당뇨병 비만인을 대상으로 한 SURMOUNT-1 연구에서 티제파티드 투여 시 세 가지 용량 모두에서 위약에 비해 뚜렷하게 많이 발생하였고 이는 약제 투여 중단의 가장 흔한 원인이 었다. 위장관계 부작용은 2형 당뇨병 환자들을 대상으로 시행하여 결과가 출판된 5개의 SURPASS 연구들에서도 마찬가지인데, 이 연구들에서의 부작용 발현을 메타분석한 결과에서, 티제파티드 5, 10, 15 mg 모두 위약이나 기저 인슐린에 비해 구역, 구토, 설사의 교차비가 뚜렷하게 높았다.
저혈당 발생 역시 티제파티드는 위약에 비해 빈도가 높다. SURMOUNT-1 연구에서 혈당 54 mg/dL 미만의 저혈당 발현은 위약군에서 0.2% 발생했던 반면 티제파티드군에서는 5, 10, 15 mg군에서 각각 1.4%, 1.6%, 1.6% 발생했다[16]. 2형 당뇨병 환자를 대상으로 한 SURPASS-1 연구에서는 저혈당 기준을 70 mg/dL 미만으로 설정한 경우 위약군에서 1% 발생했던 반면 티제파티드 군에서는 5, 10, 15 mg군에서 각각 6%, 7%, 7% 발생했고, 혈당 54 mg/dL 미만의 저혈당 사례는 없었다[46].
췌장염에 대해서는 SURMOUNT-1 연구에서 위약, 티제 파티드 5, 10, 15 mg의 모든 군에서 각 1건(0.2%) 발생했으나, 티제파티드군에서 췌장 아밀라제가 기저치 대비 20% 가량, 리파제는 기저치 대비 29-35% 가량 상승하여 위약군에 비해 상승 정도가 뚜렷했다[16].
부작용 발현에 대해서 티제파티드 15 mg과 세마글루티드 2.4 mg의 직접적인 비교는 불가능하다. 2형 당뇨병 환자들을 대상으로 시행하여 결과가 출판된 5개의 SURPASS 연구들 사이의 티제파티드 부작용 발현율에 차이가 상당하다. 따라서 서로 다른 연구에서의 서로 다른 약제에 대한 부작용 발현율의 비교는 합당하지 않을 것으로 생각한다. 다만 SURPASS-2 연구[44]에서 2형 당뇨병 환자에서의 티제파티드 5, 10, 15 mg과 세마글루티드 1.0 mg을 비교할 수 있는데, 대부분의 부작용은 세마글루티드 군에 비해 티제파티드 군에서 보다 많이 나타났다. 심각한 부작용, 사망, 부작용으로 인한 약제 투여 중단 발생 사례는 티제파티드의 세 용량군 모두에서 세마글루티드 1.0 mg군보다 많았다. 구역, 설사, 구토 등 소화기계 부작용은 티제파티드 15 mg군에서 세마글루티드 1.0 mg군보다 많이 나타났으며, 저혈당은 티제파티드 15 mg군에서 두드러지게 많이 나타났다. 주사부위 이상반응, 담석 발생은 티제파티드 세 용량군 모두에서 세마글루티드 1.0 mg군보다 많이 나타났다.
결론
비만치료에서 생활습관 교정이 밑바탕이 되지만, 섭식 행동은 비만은 여러 호르몬과 신경전달물질에 의해 복잡하고 세밀하게 조절되는 섭식 조절 시스템에 의해 결정되는데, 현대의 급격한 환경 변화는 이 시스템이 인간으로 하여금 더 맛있고 고열량인 음식을 더 많이 섭취하게 하면서 활동량은 대폭 줄이기 때문에, 현재의 비만 팬데믹에 대응하기 위해서는 생활습관 교정을 뒷받침할 더 강력한 생물학적 치료 방법이 필요하다. 최근 소개된 세마글루티드와 티제파티드는 인크레틴 기반 펩타이드 제제로서 비교적 괜찮은 안전성과 함께 강력한 체중감량 효과를 보여 앞으로의 비만치료에 좋은 선택지가 될 것이다. 이 논문에 소개된 약제 외에도 개발 중인 약제들이 있어서 향후 비만에 대해 더 효과적이고 안전한 약물이 사용 가능해질 것이다.
Notes
Conflict of Interest
Yoon Jeong Cho got honorarium from Chong Kun Dang, Kwangdong, Alvogen, Novo Nordisk and involves in clinical trials of Chong Kun Dang’s products. Kyoung-Kon Kim got honorarium from Chong Kun Dang, Hanmi Pharmaceutical, Kwangdong, Alvogen, Novo Nordisk and financial support for advisory service from Novo Nordisk and involves in clinical trials of Novo Nordisk’s products.
References
Peer Reviewers’ Commentary
먹을 것이 풍부해지고 잘 먹는 것에 치중한 사회적 분위기로 항상성 기전에서 쾌락 기전으로 섭식 행위가 변하면서 고칼로리, 고지방, 고당분의 정제된 식사 섭취가 증가하였다. 이에 따라 비만 유병률이 급격하게 증가하고 있고, 소아부터 성인까지 다양하고 심각한 신체적, 정신적 합병증을 야기하고 있다. 이 논문은 비만의 발생 기전에 대한 설명과 함께 현재 사용이 가능한 비만 약제뿐만 아니라 가까운 시일에 사용이 가능할 것으로 예상되는 약제까지 잘 정리하여 설명하고 있다. 특히 국내 출시 이전이지만 뛰어난 체중감량 효과로 비만 치료의 게임 체인저로 기대를 모으고 있는 세미글루티드와 티제파티드에 대한 최근 임상 연구 결과들을 독자들이 이해하기 쉽게 잘 설명하고 있다. 이 논문은 임상 현장에서 비만치료제의 최신 지견을 이해하는 데 많은 도움을 줄 것으로 판단된다.
[정리: 편집위원회]