흉부 대동맥류의 진단과 치료
Diagnosis and treatment of thoracic aortic aneurysm
Article information
Abstract
Thoracic aortic aneurysm (TAA) is the most common pathology of the thoracic aorta. The incidence of TAA is increasing and the true incidence of TAA is likely to be higher than currently reported because of its inherently silent nature. TAAs are an increasingly recognized condition that is diagnosed incidentally on imaging studies performed to evaluate unrelated conditions because most patients with TAA have no symptoms. TAAs normally grow in an indolent manner, but can become rapidly lethal once dissection or rupture occurs. Indeed, aortic aneurysms (both abdominal and thoracic) represent the 15th leading cause of death in individuals older than 55 years, and the 19th leading cause of death in individuals of all ages in the United States. The etiologies underlying TAAs are diverse. Therefore, the evaluation and management of TAAs are complex. The present review summarizes the knowledge of the pathophysiology, natural history and diagnostic modalities, as well as current treatment strategies of TAA on the basis of current literature.
서론
흉부 대동맥류는 인구 10만 명당 매년 약 5.6-10.4명 정도의 발생률을 보이며 고혈압이 없는 일반군에서도 약 4.2%까지 유병률을 보인다[1]. 대부분의 흉부 대동맥류는 증상이 없으나 쉰 목소리, 흉통, 요통 등의 증상을 보일 수 있다. 이러한 증상이 있을 경우 파열이나 박리의 위험성은 높아진다. 흉부 대동맥류는 다른 심혈관질환에 비하여 흔하지 않지만 치료하지 않거나 진단되지 않은 경우 파열이나 박리의 결과를 야기할 수 있다. 흉부 대동맥류는 파열이나 박리가 발생하였을 경우 사망률이나 이환율이 매우 증가하며 좋지 않은 예후를 가지기 때문에 조기 발견을 통하여 적절한 시기에 치료를 시행하여야 한다.
정의
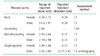
일반적으로 동맥의 정상 직경보다 50% 이상 늘어나 있는 것을 동맥류라고 정의한다. 그러므로 흉부 대동맥류를 진단하기 위해서는 정상 혈관의 크기를 아는 것이 중요하다. 대동맥의 정상 직경은 나이, 성별, 체형과 위치에 따라서 다르게 나타난다. 남자가 여자보다 대동맥 직경은 좀더 크게 나타나며 체표면적이 클수록 대동맥 직경은 커진다[2]. 대동맥 직경은 나이가 들어갈수록 커지며 대동맥 근위부에서 말초부위로 갈수록 점차적으로 작아지는 경향을 보인다[3]. Hannuksela 등[2]은 매년 평균 0.17 mm (0.12-0.20 mm) 정도로 대동맥의 직경이 나이가 증가함에 따라 증가하고 체질량지수당 평균 0.27 mm (0.14-0.44 mm) 정도의 직경 증가가 일어난다고 하였다. 또 성별에 따라 평균 1.99 mm (1.28-2.60 mm) 정도의 차이가 나며 나이가 들어감에 따라 이러한 차이는 감소한다고 보고하였다(Table 1)[4].
흉부 대동맥은 일반적으로 4개의 부분으로 나누어진다. 대동맥 판막, 대동맥 판막 환형, 발살바동을 포함하는 곳을 대동맥 근위부라 하고, sinotubular junction에서 시작하여 무명동맥 시작부위까지를 상행대동맥이라 한다. 무명동맥 시작부위부터 왼쪽 쇄골하동맥을 포함한 부위까지가 대동맥 궁이며 왼쪽 쇄골하동맥 시작부위와 동맥관인대 사이에 있는 대동맥 협부에서 횡경막까지를 하행 대동맥이라고 분류한다(Figure 1). 흉부 대동맥류는 한군데 이상을 침범하기도 한다[5]. 대동맥류가 흉부 하행대동맥에서 복부 대동맥까지 침범한 것을 흉복부 대동맥류이라고 하는데 이러한 흉복부 대동맥류에 대해서는 Crawford 분류법에 의하여 5가지로 분류한다(Figure 2). 이러한 분류들은 모두 수술적 치료에 도움을 준다. 흉부대동맥에서 대동맥류의 발생 비율은 근위부와 상행대동맥이 약 40% 정도로 가장 빈번하고 하행 흉부대동맥이 35%, 대동맥 궁은 15%, 그리고 흉복부 대동맥이 10%정도로 나타난다[5].
흉부 대동맥류의 자연 경과
흉부 대동맥류의 팽창 속도는 대동맥류의 병인, 크기, 그리고 위치에 따라서 다르게 나타난다. 상행 대동맥류는 약 1 mm/yr의 속도로 커지나 하행 흉부 대동맥은 약 2.9 mm/yr 의 속도로 좀더 빠르게 진행한다[6]. 그리고 대동맥류는 대동맥의 크기가 커질 수록 더 빠른 속도로 증가하며 대동맥 박리나 대동맥류의 병인에 따라서 더욱 증가할 수 있다(Table 2) [67]. Familial type의 흉부대동맥류의 경우 sporadic type(약 1.6 mm/yr)보다 더 빠른 약 2.1 mm/yr의 속도로 커진다는 보고가 있으며 Loeys-Dietz syndrome을 가진 환자에 있어서는 10 mm/yr의 속도로 증가한다고 보고되고 있다[7]. 또한 여성, 고령, 만성폐쇄성폐질환 및 고혈압의 존재 유무, 대동맥류의 가족력 등도 흉부 대동맥류를 악화시키는 위험인자로 알려져 있다.
흉부 대동맥류의 약 95%는 파열과 같은 급성 증상이 생기기 전에 무증상으로 발견이 되는 경우가 대다수 이다. 흉부 대동맥류의 파열이 발생할 경우 예후는 매우 좋지 않다. Johansson 등[8]은 흉부 대동맥류 파열이 발생한 환자의 약 41%만이 살아서 병원에 도착하였고 이들 중에서 하행 대동맥의 수술적 치료의 사망률은 28.6%였으며 스텐트를 이용한 혈관 내 치료를 한 경우도 23.4%의 높은 사망률을 보였다고 보고하였다. 그러므로 흉부 대동맥류는 파열과 같은 치명적인 합병증이 생기기 전에 치료를 하는 것이 중요하다. 파열의 위험성을 고려하여 보면 Elefteriades [9]는 흉부 대동맥류의 파열에 대해 대동맥류 크기에 따른 발생 비율을 보고하였다(Table 3) [910]. 만성폐쇄성폐질환, 나이, 대동맥의 직경, 통증의 존재 등은 대동맥류 파열의 위험 요소로 알려져 있다. 그리고 Marfan 증후군이나 다른 결합조직 질환을 가진 대동맥류환자에서는 더 작은 크기의 직경에서 파열이 발생할 수도 있다.
병태생리
흉부 대동맥류는 다른 동맥류와 비슷한 기전을 가지고 있으며 유전적 요소, 염증작용, 세포외적인 요소, 세포적인 요소 등의 여러 가지 복합적인 인자들에 의하여 형성된다. 대동맥 인대의 원위부에서 발생한 대동맥질환은 죽상경화증과 매우 큰 연관성을 가지나 근위부에서는 죽상경화증과의 연관성이 떨어진다[10]. 이러한 차이는 발생학적인 기원이 다르기 때문이다. 상행 대동맥의 평활근 세포는 신경관(neural crest) 세포에서 유래되었으며 하행 대동맥의 평활근 세포는 축주위 중배엽(paraxial mesoderm)에서 기원하였다[10].
동맥의 matrix에 존재하는 elastin과 collagen도 중요한 역할을 한다. Elastin은 동맥류 형성에 저항을 하는 압력을 견디는 작용을 하며 collagen은 동맥류 파열을 막는 역할을 한다[11]. Elastin의 농도는 상행 대동맥이 하행 대동맥보다 높으며 elastin-collagen 비율은 상행 대동맥에서 복부 대동맥으로 갈수록 감소하는 경향을 보인다. 대동맥의 media는 대동맥의 근위부에서 원위부로 갈 수록 점점 얇아지게 된다[12]. Matrix metalloproteinases (MMPs)에 의한 extracellular matrix의 약화는 동맥류 형성에 영향을 준다. 많은 복부 대동맥류에 대한 연구에서 이런 MMP들이 대동맥류 형성에 중요한 인자라는 것은 알려져 있는 사실이며 이는 흉부 대동맥류에서도 중요한 인자로 알려져 있다. 특히 MMP-9의 증가와 MMP-2의 활성은 대동맥류 파열과 관련성이 깊다[13].
대동맥류의 조직학적 소견은 cystic medial necrosis로 알려진 medial degeneration과 관련이 있다. Medial degeneration은 elastic fiber의 손실과 분해, 평활근의 소실, interstitial collagenous tissue, basophilic ground substance, proteoglycans 등의 축적 등으로 특징지어 진다. Medial degeneration이 정상 노화의 과정이기는 하지만 고혈압이나 죽상경화증과 같은 병인들은 이것을 가속화시킬 수 있다. Medial degeneration은 fusiform 동맥류와 연관성이 높다[14].
대동맥류는 유전적 요인에 의해서도 유발될 수 있다. smooth muscle cell의 alpha-2 actin을 encoding하는 ACTA2 gene의 mutation은 familial type의 대동맥류의 원인이 될 수 있다[15]. TGF-β receptor type 1과 type 2를 각각 인코딩하는 TGFBR1 gene과 TGFBR2 gene의 mutation은 Marfan syndrome과 Loeys-Dietz syndrome에서 발견되며 결합조직을 파괴시켜 대동맥류를 야기한다[1617].
임상증상
흉부 대동맥 환자들은 대부분에 있어서 증상을 가지고 있지 않다. 하지만 파열이 일어나기 전에는 증상을 가지게 된다. 약 57%의 흉부대동맥 환자에서 파열이 일어나기 전에 증상을 가진다는 보고도 있다[18]. 대부분의 초기증상은 모호한 통증이 가슴, 배, 등, 옆구리에서 일어날 수 있고 이러한 증상들은 다른 많은 질환들과의 감별이 필요하다. 대부분의 동맥류에 따른 증상들은 동맥류가 커지는 것과 관련하여 나타날 수 있다. 흉강 내에 흉부 대동맥의 증가로 인해 여러 구조물들이 눌리는 증상들이 나타날 수 있다. 쉰 목소리는 대동맥류에 의해 좌반회후두신경(left recurrent laryngeal nerve)이 눌리거나 늘어나는 손상으로 발생할 수 있다. 기관지 전위나 지속적인 기침 등의 호흡기 증상이 있을 수 있으며 대동맥류의 식도 압박으로 인한 연하 곤란도 발생할 수 있다. 대동맥류가 기관지나 식도로의 침식으로 인한 갑작스러운 객혈이나 토혈도 나타날 수 있다.
영상학적 진단
대동맥류는 영상의학적인 검사를 통하여 진단한다. 흉부 X-ray, 컴퓨터단층촬영(computed tomography, CT), 자기공명혈관조영술(magnetic resonance angiography), 경흉부 초음파, 경식도 초음파, 혈관조영술 등이 대동맥류의 진단에 사용된다.
흉부 X-ray는 무증상인 흉부 대동맥류를 진단하기 위한 기본적인 검사 중에 하나이다. 종격동 확장, aortic knob의 확장, 기관지 전위(tracheal deviation), displaced aortic calcification, aortic kinking, opacification of the aorto-pulmonary window 등은 흉부 대동맥류를 시사하는 소견들이다. 종격동 확장과 비정상적인 aortic contour에 대한 흉부 대동맥 질환의 민감도는 각각 64%와 71%정도 된다는 보고가 있으며 대동맥 질환에 대한 흉부 X-ray의 민감도와 특이도는 각각 약 64%와 86%정도 된다는 보고도 있다[19]. 그러나 흉부 X-ray만으로는 흉부 대동맥 질환의 존재 여부를 정확하게 감별할 수 없다.
CT는 흉부 대동맥류를 진단하는데 가장 유용한 도구 중 하나이다. 환자가 대동맥류에 대한 고위험군이거나 흉부 X-ray상 대동맥질환이 의심이 된다면 CT를 시행하여야 한다. CT는 대동맥류의 모양, 크기, 혈전의 존재여부, 주변 구조물과의 관계, 대동맥의 해부적 특징 등에 대한 정확한 평가를 할 수 있다[20]. 또한 대동맥벽, 대동맥 내강, 대동맥의 해부적인 변이 여부, 그리고 대동맥에서 분지되는 혈관 등에 대한 정보를 얻을 수 있어 다른 대동맥 질환과의 감별을 하는데 도움을 주며 수술적 치료의 계획을 세우는 데에도 많은 정보를 제공한다. CT는 대동맥 질환에 있어서 이상을 발견하는데 약 92%정도의 정확성를 가진다는 보고가 있으며 95%이상의 민감도와 특이도를 보여준다고 알려져 있다[21]. CT는 자기공명영상(magnetic resonance imaging, MRI)에 비하여 좀더 가격이 싸고 검사시간이 짧은 장점이 있다.
MRI는 대동맥질환을 진단하는 것에 있어서 매우 정확한 검사이다. 이것은 CT나 transeophageal echocardiography보다 더 좋은 민감도와 특이도를 가진다고 알려져 있다[22]. CT와 비슷하게 두개골 밑에서부터 발끝까지의 대동맥과 분지 혈관들을 검사할 수 있으며 spinal cord circulation에 대한 map을 만드는 것에도 유용하다[23]. MRI는 조영제나 방사선 노출이 없으며 대동맥 판막이나 좌심실의 기능을 평가할 수 있다는 장점이 있으나 시간이 오래 걸리며 금속성의 기구나 인공심박조율기를 가지고 있는 환자에서는 사용할 수 없다는 단점이 있다.
혈관조영술은 과거에 대동맥류의 진단과 평가를 위해 많이 사용되어 졌다. 하지만 현재에는 CT, MRI, 심초음파와 같은 다른 진단 도구들에 비하여 사용이 제한적이다. 왜냐하면 혈관조영술을 하기 위해서는 숙련된 의사가 필요하며 조영제를 사용하는 침습적인 시술이기 때문에 합병증의 발생 가능성이 있다. 또한 혈관 밖의 정보를 얻는 것에 제한적이다[24]. 혈관조영술은 수술 후 하지 마비를 예방하기 위한 Adamkiewicz's spinal artery나 great radicular artery를 확인하기 위한 spinal cord circulation의 mapping을 하기 위해 제한적으로 사용되어 진다[23].
경흉부심초음파는 대동맥과 대동맥의 주된 분지 혈관들을 평가할 수 있지만 흉벽으로부터 대동맥 궁과 하행 대동맥까지의 거리가 멀고 폐와 다른 종격동 구조물의 방해로 인하여 대동맥류의 평가에 제한점이 있다. 하지만 경식도심초음파는 이러한 단점을 극복하게 해주어 흉부 대동맥의 모든 부위를 잘 평가할 수 있다. 심초음파는 CT나 자기공명혈관조영술에서 평가하기 힘든 대동맥 근위부의 상태나 대동맥 판막의 상태를 좀더 잘 알 수 있으며 심장기능을 같이 평가할 수 있는 장점이 있으며 가격도 상대적으로 저렴하다(Table 4)[25].
약물치료
약물치료는 open repair나 endovascular repair에 비견될 만한 level A나 level B의 증거를 가지고 있는 것은 없다. 하지만 이런 것들은 수술적 적응증에 속하지 않는 동맥류에 도움을 줄 수 있다. 2010 American Heart Association (AHA) guideline은 "Stringent control of hypertension, lipid profile optimization, smoking cessation, and other atherosclerosis risk-reduction measures should be instituted for patients with small aneurysms not requiring surgery, as well as for patients who are not considered to be surgical or stent graft candidates."라고 권장하였다[5].
2010 American College of Cardiology Foundation (ACCF)/AHA guideline에서 당뇨가 없는 환자에서는 혈압의 목표를 140/80 mmHg보다 낮게 유지하고 당뇨나 만성신부전이 있는 환자에서는 130/80 mmHg 이하로 유지하는 것을 제안하고 있으며 Marfan's syndrome과 대동맥류가 있는 환자에서는 beta blocker를 사용하여 대동맥 팽창률을 줄이도록 권고하고 있다[5].
Beta blocker는 좌심실수축력과 shear stress를 감소시키고 대동맥 팽창률을 줄여준다[14]. 이것은 Marfan's syn-drome에서 대동맥류의 진행을 늦추고 사망률을 감소시키는 효과가 있다[26]. 아직 degenerative aortic aneurysm에 대한 beta blocker의 효과는 확실하게 증명되지는 않았지만 심근경색 같은 심혈관질환의 사망률을 낮추어 주며 대동맥 확장을 늦추어주는 효과로 인하여 2010 ACCF/AHA guideline에서 class IIa recommendation으로 권장하고 있다.
Oxidative stress는 퇴행성 대동맥류의 발달에 영향을 미치며 renin-angiotensin system이 여기에서 중요한 역할을 한다고 알려져 있다[27]. Angiotensin II type 1 receptor blocker는 대동맥류에서 reactive oxygen species의 발현을 억제하여 대동맥류 치료에 도움을 준다.
HMG-CoA reductase inhibitor는 cholesterol을 낮추는 효과뿐만 아니라 염증을 억제시키는 효과도 있다. 대동맥류의 병태생리 중에 NADH/NADPH oxidase는 중요한 역할을 한다고 알려져 있다. HMG-CoA reductase inhibitor는 이런 NADH/NADPH oxidase를 억제시키는 것을 통하여 대동맥류의 형성을 억제하는 효과를 가진다. 비록 이러한 효과가 흉부 대동맥류에서는 아직 확실하게 밝혀지지는 않았지만 복부 대동맥류의 연구에서 사망률과 대동맥류 성장률을 감소시킨다는 보고들이 나오고 있어 간접적으로 흉부 대동맥류에 대한 효과를 입증하고 있다[2829]. 2010 ACCF/AHA guideline에서도 대동맥류를 가진 환자는 statin으로 target low density lipoprotein cholesterol을 70 mg/dL 이하로 치료하라고 권고하고 있다.
흡연이나 만성폐쇄성폐질환을 가진 환자에서 흉부 대동맥류의 악화에 대한 위험성이 더 커진다. 흡연이 흉부 대동맥류를 가진 환자에 있어서 2배의 동맥류 팽창률을 가진다는 보고도 있다[30]. 금연이 흉부 대동맥에 미치는 영향에 대한 대규모무작위연구가 진행되지는 않았지만 복부 대동맥류에서 대동맥류의 악화에 많은 영향을 미친다는 것은 잘 알려진 사실이다. 금연도 statin과 마찬가지로 흉부 대동맥에서 중요한 치료방법이라고 생각되어 진다.
수술 적응증
흉부 대동맥류의 파열이 발생할 경우 매우 높은 사망률을 가지기 때문에 파열 전에 수술적 치료가 필요하다. Coady 등[6]은 흉부 대동맥류의 직경이 증가함에 따라 어떤 hinge point에서 대동맥류 파열이나 박리의 위험이 증가한다고 하였다. 상행 대동맥에서는 이런 hinge point가 6 cm이며 이 이상에서 파열이나 박리의 위험성이 급격하게 증가하고 하행 대동맥에서는 7 cm 이상에서 그 위험성이 매우 증가한다고 하였다. 하지만 상행 대동맥류는 hinge point인 6 cm에 도달하기 전에도 약 31%의 환자에서 이미 대동맥류 파열이나 박리로 고통을 받거나 사망을 하는 환자들이 있으며 하행 대동맥에서도 7 cm 이하에서도 약 43%의 환자에서 파열이나 박리가 발생한다는 보고도 있다[9]. 그러므로 이런 hinge point에 도달하기 전에 수술이나 시술을 시행하여야 한다(Table 5). 흉부 대동맥류의 정규 수술 후에 5년 생존율은 건강한 사람과 거의 비슷한 약 85%를 보이는 반면 응급 수술 후의 5년 생존율은 오직 37%로 낮은 생존율을 보인다[31].
2010 ACCF/AHA guideline에서는 무증상의 퇴행성 흉부 대동맥류, 세균성 동맥류, 가성 동맥류가 있는 환자에서 상행 대동맥나 aortic sinus의 직경이 5.5 cm 이상일 때 수술적 치료를 해야 하며 Marfan's syndrome이나 다른 유전적 질환은 이보다 직경이 더 적은 4.0-5.0 cm에서 수술적 치료를 권고하고 있다. 또한 대동맥의 직경이 5.5 cm 이하라 하더라도 증가율이 0.5 이상인 경우에 수술적 치료가 필요하며 대동맥 판막의 수술적 치료를 고려하는 경우 상행 대동맥 또는 대동맥 근위부의 직경이 4.5 cm 이상인 경우에도 판막과 대동맥의 수술을 동시에 할 것을 권유하고 있다[5]. 많이 쓰이지는 않지만 Marfan's syndrome, 유전적 질환 또는 이엽성 대동맥 판막를 가진 환자에서 최대 상행 대동맥 또는 대동맥 근위부 면적을 환자의 키로 나눈 값이 10 이상이 넘으면 수술적 치료를 결정하기도 한다. [(n×(대동맥직경(cm)/2)2÷환자의키(m))≥10] [32] 흉부 대동맥류로 인해 야기되는 증상은 파열이나 박리의 예측변수이다[31]. 흉부 대동맥류와 관련된 증상이 있는 경우 수술적 치료의 적응증이 된다.
수술 전 평가
심근 경색, 저심장 박출량, 호흡부전, 신부전, 뇌경색 등은 흉부 대동맥 수술 후 사망률과 이환율을 만드는 중요한 원인들이다. 일반적으로 흉부 대동맥류 치료를 받는 사람은 보통 나이가 많으며 심근기능의 저하 및 관상동맥의 죽상경화증을 동반하는 경우가 많다. 흉부 대동맥류 수술 후 심장질환은 주된 사망의 원인이다. 심장질환은 후기 사망률의 1/3을 차지하고 초기 사망률의 1/2를 차지한다는 보고도 있다[33]. 그러므로 흉부 대동맥류 수술 전에 심장과 관상동맥에 대한 평가가 이루어져야 한다. 관상동맥질환이 존재한다면 수술 전이나 수술 중에 치료가 이루어져야 한다. 환자가 관상동맥 스텐트 시술을 시행한다면 clopidogrel을 최소 6주 이상 사용하여야 하기 때문에 수술이 지연될 수 있음을 고려해야 한다. Drug-eluting stent의 사용은 clopidogrel을 지속적으로 사용해야 하기 때문에 지양해야 한다. 관상동맥 우회로술을 시행할 때에도 좌내흉동맥을 사용하는 것은 척수의 혈류 공급에 영향을 줄 수 있기 때문에 신중하게 선택하여야 한다.
호흡기에 대한 합병증도 수술 후 사망률을 증가시키는 요인이다. 수술 전 폐기능 검사와 동맥혈 검사는 항상 진행되어야 하며 폐 기능을 향상시키기 위한 금연이나 기관지확장제의 적절한 사용 등을 시행하여야 한다. 수술 중에도 좌반회후두신경(left recurrent laryngeal nerve)과 횡격막신경(phrenic nerve)이 다치지 않도록 조심하여야 수술 후 발생할 수 있는 호흡기계 합병증을 줄일 수 있다.
수술 후 신장기능부전을 줄이기 위하여 신장에 대한 평가가 이루어져야 한다. 수술 전 충분한 수액 공급을 시행하며 저혈압, 저심박출, 저혈량상태를 피하는 노력이 필요하다. 또 신장 혈관 협착증이 있는 경우에는 스텐트 삽입이나 우회로술 등의 치료가 신장 기능을 보존하는 데 도움을 줄 수 있다[34].
수술적 치료
수술은 동맥류로 인하여 파열 또는 박리 등과 같은 합병증이 발생할 수 있는 부위를 제거하고 인조혈관으로 치환하는 것을 일반적인 원칙으로 한다. 수술은 대동맥이 위치한 부위에 따라서 접근방법이 달라지며 동맥류가 여러 부위를 침범한 경우에는 파열의 위험도 및 수술에 따르는 위험도에 따라서 우선 순위를 정하여야 한다.
상행 대동맥의 치환은 일반적인 개심술과 큰 차이가 없다. 흉골 정중 절개를 시행한 후 심폐 바이패스 하에 무명 동맥 입구 직전에 상행 대동맥을 차단하고 인조혈관으로 치환을 시행한다. 대동맥 근위부에 병변이 있어 대동맥 근위부까지 치환을 하는 경우는 관상동맥 개구부를 인조혈관에 재접합하는 과정이 필요하다. 여기에는 Bentall procedure, Cabral procedure, David aotic root reimplantation등의 여러 술식들이 사용되고 있다.
대동맥 궁 치환을 위한 접근은 병변의 범위에 따라서 결정된다(Figure 3). 대동맥 궁 치환술을 시행할 때 뇌로 가는 혈류를 차단해야 하는 완전 순환 정지(total circulatory arrest)를 사용해야 하기 때문에 뇌를 보호하는 방법을 고려해야 한다. 뇌의 허혈 시간을 줄이고 공기, 혈전, 조직 파편 등의 색전성 물질들이 뇌로 날아가는 것을 최소화해야 한다.
저체온하 완전 순환 정지를 시행할 때 심부 체온이 15도에서 약 30분 정도, 10도에서 약 40분 정도의 시간에는 뇌로 혈류가 가지 않더라도 영구적인 뇌조직 손상이 없는 것으로 알려져 있다[35]. 대동맥 궁 수술 시에는 이런 저체온법을 통하여 뇌 보호를 시행하며 최근에는 오른쪽 액와 동맥에 동맥관을 삽입하여 완전 순환 정지 상태에서도 선택적으로 뇌 조직에 관류를 유지하는 방법을 사용하기도 한다.
순환 정지 상태에서 상대정맥관을 통하여 산소화된 혈액을 뇌조직으로 역행적으로 주입하는 것도 뇌를 보호하는 효과가 있다고 보고되고 있다. 이러한 방법은 정맥으로 주입된 혈액이 모세혈관을 통하여 뇌조직에 전달될 수 있고 동맥을 통하여 들어갈 수 있는 공기나 혈전 등의 색전을 제거해 낼 수 있다고 보고되고 있다[36]. 뇌조직을 보호하기 위한 위의 방법들은 단독으로 하기도 하고 여러 가지 방법을 동시에 사용하기도 한다. 아직 어느 방법이 우수한지는 여전히 논란 거리로 남아 있으며 더 많은 연구가 필요하다.
하행 흉부대동맥 치환을 위해서는 좌측방 개흉술을 시행하며 흉복부 대동맥 노출을 위해서는 좌측방 개흉을 시도하고 복부까지 절개부를 연장하여 시행한다(Figure 4). 횡격막을 절개할 때는 수술 후 호흡기능을 보존하기 위하여 횡격막의 가장자리를 따라 원형으로 절개함으로써 횡격막 신경을 손상을 피하는 것이 좋다.
흉부 대동맥 수술 시에 흉부 대동맥을 겸자로 차단을 할 경우 좌심실에 후부하가 많이 걸리면서 심장에 부담을 주게 되며 차단 부위의 원위부 쪽으로 허혈에 따른 손상을 유발할 수 있다. 그래서 흉부 대동맥 치환 시에는 체외순환장치를 사용하여 좌심방이나 폐정맥에서 혈액을 배액하여 대퇴 동맥 또는 원위부 대동맥에 관을 연결하여 관류를 시켜주는 좌심 바이패스 방법을 사용하기도 하고 대퇴정맥을 통하여 우심방까지 관을 삽입하여 혈액을 배액하여 산화기를 통하여 혈액을 산소화시켜 대퇴동맥 혹은 원위부 대동맥으로 산소화된 혈액을 관류시켜주는 부분 체외순환방법등을 사용한다.
흉복부 대동맥류의 치료 시에 하행 흉부 대동맥을 차단하는 경우 척수로 가는 관류압이 감소하고 시간이 경과하면 허혈 손상이 발생하여 하지 마비가 발생할 가능성이 있다. 척수에 혈류를 공급하는 혈관들로는 anterior spinal artery, intercostal artery와 lumbar artery에서 나오는 radicular artery들이 있다. Radicular artery들 중에서 가장 큰 분지를 greater radicular artery라고 하며 Adamkiewicz's artery 또는 arteria radicularis magna라고도 불려진다. 이 동맥은 척수의 관류에 매우 중요한 역할을 하며 수술 시에도 이 동맥을 찾아서 반드시 인조혈관과 연결을 해주는 것이 중요한 과정으로 여겨지고 있다. 또한 흉복부 대동맥 치환 시에 척수의 허혈손상을 예방하기 위해서 여러 가지 방법들이 사용되고 있다. 수술 중 Adamkiewicz's artery를 찾아서 재접합을 해주는 방법, 수술 중과 직후에 동맥혈압을 적절하게 유지해주고 뇌척수액을 배액하여 뇌척수강의 압력을 낮추어주는 방법과 저체온을 유지하는 방법 등을 사용하여 척수 손상을 예방하려는 노력을 하고 있다.
수술 합병증
수술 후 심근경색은 약 1-5% 정도 발생한다. 이것은 보통 관상동맥 개구부(coronary ostium)의 박리나 관상동맥질환과 관련되어 나타난다[37]. 심부전은 1-5% 정도 발생하며 인공심폐기 사용 시 심근보호의 문제와 심실의 과도한 확장 등에 의해서 발생된다[38]. 이 외에도 감염(1-5%), 뇌경색(2-8%), 출혈에 의한 재수술(1-6%), 심실 부정맥(1-5%) 등이 발생할 수 있다. 수술 후 호흡부전은 5-15% 정도로 발생 가능성이 높다. 인공심폐기 사용시간을 줄이고 과도한 수혈을 피하는 것은 호흡부전을 줄일 수 있는 방법이며 이 외에도 횡격막 절개나 과도한 인공호흡기 시간과 수액을 줄이는 것은 호흡부전을 예방할 수 있다. 하지 마비는 하행 대동맥 수술 시에 약 2-4% 정도 나타나며 흉복부 대동맥 수술 시에는 3-10%정도 발생한다고 보고되고 있다[39]. 대부분은 운동기능에 문제를 나타내며 paraparesis의 2/3와 paraplegia의 1/2 정도의 환자들은 회복할 가능성을 가진다. 수술 후 저혈압을 피하고 지속적인 척수액 배액을 40시간 이상 유지할 시에 이러한 하지마비를 줄일 수 있다[40].
상행 대동맥과 대동맥 궁의 수술은 약 1-5% 정도의 사망률을 보이며 하행 흉부 대동맥 수술의 사망률은 약 2-5%정도 발생한다고 보고 되고 있다[39]. 흉복부 대동맥은 Crawford type II에서 높은 사망률과 이환율을 보이며 약 5-12% 정도의 사망률을 가진다고 알려져 있다[33].
스텐트를 사용한 혈관 내 치료
1990년대에 들어서면서 동맥류에 가해지는 압력을 제거하기 위한 방안으로 스텐트 삽입술이 시작되었다. 상행 대동맥이나 대동맥 궁에 대한 혈관 내 스텐트 치료(endovascular stent graft)는 아직 미국 식품의약국에서 사용허가를 받은 것이 없다. 하행 대동맥류에 대한 스텐트를 사용한 혈관 내 치료 적응증은 수술적 치료에서와 같다.
시술 전에 컴퓨터단층혈관조영술을 통하여 흉부, 복부, 골반 및 대퇴 동맥들에 대한 3차원 영상을 얻고 대동맥의 내경과 외경에 대한 평가가 이루어져야 한다. 그리고 스텐트가 위치할 근위부와 원위부의 안전한 landing zone을 확인하고 대동맥의 굴곡과 비틀리 정도를 측정하여 endoleak의 위험성을 평가하여야 한다. 자기공명혈관조영술도 이러한 평가에 사용될 수는 있지만 혈관 벽의 석회화를 평가하는 것에 제한이 있다[41].
시술 시에 척수에 혈류공급에 문제가 있을 것이라고 판단이 된다면 뇌척수액 배액을 시행하는 것이 하지 마비의 예방에 도움을 줄 수 있다[42]. 흉부 대동맥류에 혈류로 인한 압력이 배제되기 위해서는 스텐트에 정상적인 대동맥벽과의 접촉이 있어야 한다. 이것을 landing zone이라고 하는데 복부 대동맥류에 비하여 흉부 대동맥류에는 좀더 많은 힘이 가해지기 때문에 약 2 cm 정도의 충분한 landing zone이 있어야 한다. 이러한 landing zone의 확보가 없다면 스텐트의 허탈, 이동 등의 합병증이 발생할 확률이 높아진다.
척수 허혈의 합병증은 약 3-11% 정도로 나타나며 뇌경색도 약 4-8% 정도로 수술적 치료와 비슷한 확률로 나타난다[43]. 상지 허혈에 의한 증상은 약 15% 정도에서 발생하나 이 중 시술이 요구되는 증상은 5.3% 정도로 보고된다[44]. 급성 신장 손상은 약 14%에서 발생하며 생존율을 낮추는 요인으로 작용한다[45]. Postimplantation syndrome은 초기에 발생하며 백혈구 증가증, 열, 염증 요소들의 증가 등을 특징으로 한다. 이것은 endoprosthesis에 의한 내피세포의 활성때문이라고 생각된다. 이런 반응으로 인하여 편측 또는 양측 흉막 삼출이 약 47-73%까지 발생하기도 한다[46]. 후기 합병증 중에 가장 흔한 것은 endoleak이며 3.9-15.3% 정도로 발생하며 스텐트의 이동은 약 1-2.8% 정도 발생하며 6-12개월 사이에 잘 발생한다고 알려져 있다[47].
수술적 치료 vs. 스텐트를 이용한 혈관 내 치료
이전 연구들은 혈관 내 스텐트 치료가 수술적 치료에 비하여 초기 수술 사망률이 더 낮지만 재시술률이 높다고 보고하였다. 하지만 최근 von Allmen 등[48]이 보고한 바에 따르면 수술과 스텐트를 사용한 혈관 내 치료의 수술 사망률과 1년 생존율은 비슷하게 나타났다. 그러나 5년 생존율에 있어서 수술적 치료가 더 높다고 보고하였다. 하지만 대동맥과 관련된 사망률로 보정하였을 경우 두 그룹간의 차이는 없다고 하였다. 대동맥류 치료 후에 재시술이나 재수술의 시기는 스텐트군이 더 빨랐으며 5년 이내에 재시술이나 재수술을 받은 확률도 스텐트군에서 더 높게 나타났다(23.1%:14.3%). 아직도 여전히 스텐트 시술과 수술적 치료에 대한 효율성과 우수성에 대해서는 시간이 흐르면서 결과가 바뀌고 있으며 논란의 여지가 많다. 이에 대해서는 앞으로 좀더 대규모의 연구가 필요할 것이다[48].
결론
흉부 대동맥류는 대부분 증상이 없기 때문에 진단하기가 쉽지 않으며 대부분 우연히 발견되는 경우가 많다. 흉부 대동맥류는 진단이 되지 않거나 치료되지 않는 경우 파열이나 박리와 같은 치명적인 합병증을 야기하며 이러한 경우 매우 좋지 않은 예후를 가지게 된다. 흉부 대동맥류는 파열이나 박리와 같은 합병증이 발생하기 전에 치료를 시행하여야 한다. 고전적으로 수술적 치료가 원칙이나 최근 여러 기구와 기술의 발전으로 인하여 스텐트 치료의 성적이 좋다는 보고들이 많이 나오고 있다. 하지만 수술적 치료와 스텐트 치료의 선택은 아직 논란의 여지가 많기 때문에 환자의 상황에 맞추어 두 가지 치료법의 장단점을 고려하여 치료 방법을 선택하여야 할 것이다.
Peer Reviewers' Commentary
우리나라의 사회 고령화에 따라 가장 두드러지게 변화 되어 가고 있는 질병 양상 중에 대동맥 질환이 특히 눈에 띄는 것이라고 할 수 있겠습니다. 더욱이 TEVAR (Thoracic endovascular aortic repair) 와 같이 수술에 비해 덜 침습적인 치료 방법이 날로 발전함에 따라 수술이 어렵거나 금기가 되는 많은 노인층이 혜택을 볼 수 있게 되었습니다. 본 논문은 퇴행성 질환을 포함한 대동맥 질환의 중요성에 대한 인식이 날로 증가 하고 있는 요즘 이 질병에 대한 이해도 및 치료에 대한 지식을 전달 하기 위한 review로 매우 시기 적절하다고 할 수 있겠습니다. 내용면에서 잘 정리 되어 있고 대동맥 질환에 대한 독자의 개요적인 개념을 가지게 되는데 큰 도움이 될 것으로 판단됩니다.
[정리: 편집위원회]