 |
 |
- Search
| J Korean Med Assoc > Volume 66(3); 2023 > Article |
|
Abstract
Background: Lung cancer is representative of a high frequency and high mortality disease and ranks at the top in incidence and mortality in Korea, when excluding thyroid cancer. In this manuscript, we focused on current targeted therapies for lung cancer used widely in the medical field.
Current Concepts: The majority of patients with lung cancer cannot be treated with surgery only and require chemotherapeutics or radiation therapy. Currently, classical chemotherapeutic agents, targeted agents, and immune checkpoint inhibitors are the most widely used. Recently, the Research and Development of antibody-drug conjugates is gaining attention, and this may become a more widely prescribed treatment in the future. Among the available treatment options, targeted therapy is becoming increasingly feasible and widespread for treating inoperable lung cancers, where driver mutations have been identified, and for adjuvant or neoadjuvant therapies. Next-generation sequencing (NGS) improves the ability to identify driver mutations that were previously difficult to detect and can also be performed on blood samples where no cancer tissue is available for testing. This makes it possible to identify therapeutic targets for targeted therapy more rapidly.
Discussion and Conclusion: The most common type of lung cancer in Korea is adenocarcinoma, for which a driver mutation has been identified. Newly developed drugs target previously problematic mutations or cancer cell lines that have acquired resistance induced during the treatment process. The survival rate of patients with lung cancer is expected to improve with the development of tailored treatments for targets identified from the NGS data of the patient. This paper will help clinicians understand the current state of targeted therapies for lung cancer treatment.
Current Concepts: The majority of patients with lung cancer cannot be treated with surgery only and require chemotherapeutics or radiation therapy. Currently, classical chemotherapeutic agents, targeted agents, and immune checkpoint inhibitors are the most widely used. Recently, the Research and Development of antibody-drug conjugates is gaining attention, and this may become a more widely prescribed treatment in the future. Among the available treatment options, targeted therapy is becoming increasingly feasible and widespread for treating inoperable lung cancers, where driver mutations have been identified, and for adjuvant or neoadjuvant therapies. Next-generation sequencing (NGS) improves the ability to identify driver mutations that were previously difficult to detect and can also be performed on blood samples where no cancer tissue is available for testing. This makes it possible to identify therapeutic targets for targeted therapy more rapidly.
Discussion and Conclusion: The most common type of lung cancer in Korea is adenocarcinoma, for which a driver mutation has been identified. Newly developed drugs target previously problematic mutations or cancer cell lines that have acquired resistance induced during the treatment process. The survival rate of patients with lung cancer is expected to improve with the development of tailored treatments for targets identified from the NGS data of the patient. This paper will help clinicians understand the current state of targeted therapies for lung cancer treatment.
2020년도 통계청 보고에 의하면 국내 인구 10만 명당 악성신생물에 의한 사망률은 160.1명으로 압도적 1위의 사망률을 차지하고 있으며, 더욱이 이로 인한 사망률은 지속적으로 증가하고 있는 실정이다[1]. 2019년 국가암등록통계에 의하면 해당 기간 동안 29,960명의 폐암이 새로이 발생하여 모든 암 중에서 갑상샘암 다음의 발생률 2위의 발생률을 보였으며, 5년 상대생존율은 34.7%로 췌장암, 담낭 및 기타 담도암 다음의 3번째로 나쁜 예후를 보이고 있다. 2020년도 국내에서 폐암으로 사망한 환자는 18,673명(조사망률 36.4/10만 명)으로 전체 암사망자의 압도적 1위를 차지하고 있는 대표적인 다빈도, 난치성 질환이라고 할 수 있다[2].
SEER 체계에 의한 국내 폐암의 첫 진단 시 병기상태는 원격전이 상태가 39.5%, 국소 진행 상태 25.3%, 국한 상태는 26.0%, 병기 미상의 상태는 9.1%로서 이는 국내 폐암 환자의 절반 이상이 수술만으로는 완치 목적의 치료가 불가능한 상태로 진단되고 있음을 의미한다[2]. 고가의 표적치료제와 면역치료제를 포함한 장기적인 암치료 과정과 검사비 및 치료비의 수직 상승으로 개인과 국가의 큰 부담으로 이어지고 있는 실정이다.
21세기의 시작 전후로 암세포 내 신호전달경로들이 점차적으로 규명되고, 단백질 인산화효소(kinase)들의 역할과 억제제가 개발됨으로써 다양한 표적치료제가 지속적으로 개발되어 폐암의 치료에 사용되고 있다. 폐암 조직을 이용한 차세대 유전자검사법이 널리 사용되며 기존에 발견이 어려웠던 운전자 돌연변이(driver mutation)의 발견이 용이해지고, 또 유전자검사에 사용할 수 있는 조직이 없는 경우에서도 혈액을 이용한 차세대 유전자검사법으로 치료 표적물을 발견할 수 있는 경우가 많아져 표적치료제로 치료받는 폐암 환자와 적응증은 점차 확대되고 있는 실정이다. 이러한 표적치료제들로 일정 기간의 생존기간 향상을 이루었으나, 완치에 도달하는 경우는 매우 드물며, 대다수가 일정 기간 경과 후 내성 유전자의 발현 등으로 재발을 경험하게 된다[3].
후발 주자인 programmed death 1 (PD-1), programmed death ligand 1 (PD-L1) 및 cytotoxic T-lymphocyteassociated protein 4 (CTLA4) 등에 대한 면역관문억제제들이 폐암 등에서 기존 치료법과 비교해 우수한 치료 성적을 보이면서 수술 불가능한 폐암에서 널리 사용되고 있다. 이들은 선행치료(neoadjuvant treatment), 보강치료, 항암화학요법과의 병용 등으로 지속적으로 적응증이 확대되고 있는데[4], 이들도 소수의 환자에게서만 완치에 도달하게 되며, 대다수의 환자에게선 궁극적인 치료 실패를 경험하게 되는 실정이다[5]. 면역관문억제제의 치료반응을 예측하기 위해 사용되는 바이오마커는 PD-1과 PD-L1의 발현과, 종양 돌연변이 부하(tumor mutation burden) 등이 있으나 예측력이 기대에 미치지 못하고 있다[6]. 이는 치료에 대하여 좋은 반응이 예측되는 환자군을 놓치는 것과 반응이 없을 것으로 예상되는 환자군에게서는 불필요한 치료로 인한 경제적 부담과 드물지 않게 tumor hyper-progression (종양 가속화 진행)의 부작용을 경험하게 되는 원인이 되고 있다[7].
폐암 적정성 평가의 도입 이후 폐암의 진단 과정과 치료의 표준화와 보편화가 이루어지고 있다[8]. 이 논문에서는 현재 일선 의료 현장에서 검사하고 있는 치료의 표적물과 이에 대한 표적치료제에 대하여 고찰하였다.
표피성장인자수용체(epidermal growth factor receptor, EGFR)는 ErbB 타이로신인산화효소 수용체군(tyrosine kinase receptors family; EGFR, HER-2, ErbB-3, ErbB-4) 중의 하나로, 상피세포의 성장과 분화에 관여하는 성장인자 신호와 결합해 세포 안쪽으로 신호를 전달하는 수용체 단백질이다[9]. EGFR의 세포 외 domain에 ligand가 결합하게 되면 타이로신인산화효소가 활성화되어 세포 내로 신호가 전달되며, 이에 따라 PI3K-AKT-mTOR pathway, RAS-RAF-MEK-MAPF pathway가 활성화되게 되어 세포증식, 세포 생존, 혈관신생 등이 활성화되게 된다[9]. 암세포의 표면에 EGFR이 발현되면 암세포의 성장과 분화가 일어나게 되는데, EGFR 돌연변이는 세포 신호전달체계를 지속적으로 활성화시켜 과도한 분화와 성장이 계속되도록 한다. 비소세포폐암 중 비편평세포암, 특히 샘암종(adenocarcinoma)에서 EGFR의 돌연변이가 주로 발견되며, 서양인의 경우 비편평세포암 중 약 5-15%, 아시아인의 경우 약 40-55% 정도에서 EGFR의 돌연변이가 발생하는 것으로 알려져 있다. EGFR 돌연변이는 exon 18번부터 exon 21번 사이에서 주로 발생하는데, 가장 흔한 돌연변이는 Exon 19의 결손(Exon 19 deletion)과 exon 21의 점 돌연변이(point mutation; L858R)로, 이 두 돌연변이가 전체 EGFR 돌연변이의 약 90%를 차지하는데, 이 두 변이는 다른 동반 변이뿐 아니라 치료 약제에 대한 반응을 포함하여 약간의 차이를 보이고 있다[10]. 이 외 약 10%에서는 exon 20의 삽입(Exon 20 insertion) 등의 드문 EGFR 돌연변이가 존재하는데, 이들 드문 EGFR 돌연변이는 EGFR 돌연변이 폐암에 투여하는 표적치료제에 대한 치료 성적이 상대적으로 낮은 편이다(Figure 1) [11].
EGFR tyrosine kinase inhibitors (TKI)는 EGFR의 intracellular domain의 타이로신인산화효소에 선택적으로 결합하여 하위 신호 경로를 차단한다. EGFR 돌연변이를 치료하기 위한 EGFR-TKI 약제로는 1세대 erlotinib, gefitinib, 2세대 afatinib, dacomitinib, 그리고 3세대 osimertinib, lazertinib이 개발되어 왔다. 1세대 EGFRTKI는 EGFR의 adenosine triphosphate (ATP) 결합 부위에 ATP보다 결합력이 높아 경쟁적, 가역적으로 결합하는 약제로, EGFR 신호전달체계의 활성화를 막는다[12]. 가장 먼저 개발된 gefitinib은 2상 임상인 Iressa dose evaluation in advanced lung cancer (IDEAL-I), IDEAL-II 연구결과, 과거 치료받은 적이 있는 재발, 진행된 비소세포폐암 환자에서 약 10-18%의 객관적반응률(objective response rate, ORR)을 보여 미국 식품의약국(Food and Drug Administration, FDA)의 승인을 받았다[13]. 그러나 이후 대규모 무작위, 위약 대조 3상 연구인 INTACT-I, INTACT-II가 기존의 세포독성 항암요법과 gefitinib의 병합요법에서 ORR, 진행소요기간(time to progression) 및 생존율 향상을 입증하지 못하였으며, 3상 임상연구들 (IBREESE, ISEL, INTEREST)이 실패함에 따라 2012년 gefitinib의 FDA 승인이 철회되었다. 그러나 이후 연구 (IPASS, NEJ001, WJTOG3405)이 EGFR 돌연변이 양성인 환자군에서 세포독성 항암요법과 비교하여 gefitinib의 ORR, 진행소요기간 및 생존율 향상을 모두 입증함에 따라 gefitinib은 FDA의 승인을 다시 받게 되었다[14].
이어 개발된 2세대 EGFR-TKI인 afatinib과 dacomitinib 은 ATP 결합 부위에 비가역적으로 결합하여 작용하고, erbB family에 포함된 다른 EGFR에도 작용을 한다는 차이점을 지닌다. 2상 및 3상 임상연구 결과 EGFR 돌연변이가 있는 환자에서 세포독성 항암요법이 무진행생존기간(progression-free survival, PFS) 중앙값이 5-7개월을 보인 것에 비하여 afatinib은 PFS 11개월로, 향상된 치료 성적을 확인하였다[15,16]. Afatinib은 1세대 EGFR-TKI인 gefitinib과 비교하였을 때 전체생존기간(overall survival, OS)의 차이는 없었으나 ORR, PFS의 향상을 보였다[17]. 또한 드문 EGFR 돌연변이(G719X, L861Q, and S768I)양성인 환자군에서도 gefitinib에 비하여 afatinib이 더 좋은 치료 성적을 보였다[18]. 또 다른 2세대 EGFR-TKI인 dacomitinib 역시 gefitinib과 비교한 3상 연구결과 gefitinib 군에서 PFS의 중앙값이 9.2개월이었던 것에 비하여 PFS 14.7개월로, PFS의 연장을 보였다. OS 또한 gefitinib군에서 26.8개월이었던 데 비하여 dacomitinib군에서 34.1개월로, 향상된 결과를 보였다[19].
EGFR-TKI는 EGFR 돌연변이 양성 환자에서 백금기반 세포독성 항암요법에 비하여 전체 생존 기간의 향상을 입증하였다. 환자들 간에는 상이한 임상 경과의 차이를 보이는 경우가 많은데 이는 EGFR 변이와 같이 동반되는 변이에 기인하는 것으로 추정되고 있다[20]. 또 탁월한 초기 반응에도 불구하고 대부분의 환자들이 9-12개월 후에 질병 진행을 겪게 되는데, 이는 EGFR-TKI에 대한 획득 내성에 기인한다. 내성 기전으로 MET oncogene의 증폭, AXL 활성화, human epidermal growth factor receptor (HER2) 증폭, PIK3CA 신호전달체계의 활성화, 소세포암으로의 조직형 변화 등의 다양한 기전들이 제시되고 있다. 이 중 가장 대표적인 내성 기전은 EGFR의 exon 20번에 T790M 변이를 가진 클론의 증가가 있는데 이는 전체 내성 기전의 약 50-60%를 차지한다. T790M 돌연변이는 exon 20번의 790번 자리에서 threonine이 부피가 큰 methionine으로 치환되는 것으로 ATP가 결합하는 EGFR의 ATP-binding pocket에 T790M 돌연변이가 생기면서 ATP에 대한 affinity가 증가되어 wild type처럼 바뀐다고 알려져 있다[21]. 내성 기전을 극복하기 위해 T790M 돌연변이를 표적으로 한 약제의 개발이 이어지게 되었는데, 이러한 약제에는 3세대 EGFR-TKI인 osimertinib과 lazertinib이 있다.
Osimertinib은 EGFR tyrosine kinase의 ATP-binding site의 cysteine-797 잔기에 결합하여 EGFR T790M 내성변이를 선택적이며 비가역적으로 억제한다[22]. Exon 19deletion, L858R, L861Q point mutation과 같은 EGFR 돌연변이와 T790M 돌연변이를 모두 타겟으로 한다[23]. 1세대 EGFR-TKI로 1차치료 후 질환이 진행된 EGFR T790M 돌연변이 양성 국소 진행성 또는 전이성 비소세포폐암 환자 410명을 대상으로 한 3상 임상연구인 AURA3 결과, osimertinib은 백금기반 2제 항암요법 대비 유의하게 좋은 ORR (osimertinib군 71% 대 백금기반 2제 항암요법군 31%)과 PFS (osimertinib군 10.1개월 대 백금기반 2제 항암요법군 4.4개월)를 보였다[24]. 이에 따라 1차치료로 1세대, 2세대 EGFR-TKI 치료 이후 질환이 진행하게 되면 T790M 돌연변이 유무에 대한 검사가 필요하며, T790M 돌연변이가 확인되는 경우 3세대 EGFR-TKI를 사용하는 것이 표준치료로 자리 잡게 되었다. Osimertinib은 T790M 돌연변이뿐 아니라 EGFR 감수성 돌연변이도 타겟으로 하는 만큼, 1차요법 실패 후가 아닌 1차치료부터 osimertinib을 투여하는 것의 효과에 대한 임상연구도 진행되었는데, 이것이 바로 FLAURA 연구이다[25]. FLAURA 연구는 치료 경험이 없는 국소 진행성 또는 전이성 EGFR 감수성 돌연변이 양성 비소세포폐암 환자를 대상으로, 1세대 EGFR-TKI인 gefitinib 또는 erlotinib과 osimertinib을 비교하였다. FLAURA 결과에 의하면, osimertinib은 1세대 EGFR-TKI에 비해 높은 PFS (osimertinib군 18.9개월 대 1세대 EGFR-TKI군 10.2개월)와 OS (osimertinib군 38.6개월 대 1세대 EGFR-TKI군 31.8개월)를 보여주었다. 또 다른 3세대 EGFR-TKI인 lazertinib은 2021년 1월 한국 식품의약품안전처의 허가를 받은 약제로, 1-2세대 EGFR-TKI에 내성이 생긴 T790M 돌연변이 양성 국소 진행성 또는 전이성 비소세포폐암 환자 치료에 사용이 가능하며 현재 1차치료로 임상 3상을 진행 중에 있다. 전임상연구 결과 lazertinib은 EGFR wild type과 돌연변이를 구별하는 선택성이 우수한 것으로 나타났는데, lazertinib의 타겟이 되는 EGFR T790M, Exon19 deletion, L858R에는 osimertinib과 유사한 억제 효과를 보이는 반면 EGFR wild type에 대해서는 osimertinib에 대비하여 억제 효과가 적었다. Lazertinib은 동물 모델 실험에서 단일(Del19) 및 이중(L858R/T790M) 돌연변이에 대해 우수한 항종양 효과를 나타냈으며, 뇌전이 동물 모델 에서 높은 뇌혈관 장벽(blood-brain-barrier) 투과도를 보였다[26]. 임상 1/2상인 LASER201 연구(ClinicalTrials. gov identifier: NCT03046992)[27] 결과, lazertinib 240 mg 용량군에 배정된 환자(n=78) 중 T790M 돌연변이 양성 환자(n=76)에서 ORR은 55.3%, PFS의 중앙값은 11.1개월이었다. 240 mg 용량군에서 측정 가능한 뇌전이가 확인된 환자의 intracranial ORR은 86%, intracranial PFS의 중앙값은 26.0개월로 확인되어 유망한 결과를 보여주었다. LASER201 연구에서는 lazertinib의 안정성에 대해서도 보고하고 있는데, 전체 용량군(n=181)에서 3등급 이상의 치료 관련 이상반응(treatment emergent adverse events, TEAE)은 29%, 3등급 이상의 약물 관련 TEAE는 8%로 다른 EGFR-TKI와 유사했다. 무엇보다 lazertinib의 안정성 관련 가장 큰 장점은 심독성이 적다는 것이다. 심전도 QTc 간격 연장이나 좌심실 박출률 감소 등의 심독성은 nilotinib, lapatinib, 그리고 osimertinib의 투여 시 연관되어 발생할 수 있는 부작용으로 보고되어 있다. 그 기전은 명확하지는 않으나 HER2 억제가 연관이 있는 것으로 여겨지고 있다[28]. 따라서 osimertinib에 비하여 EGFR 돌연변이 선택성이 우수한 lazertinib의 경우 심독성의 부작용이 상대적으로 적은 것으로 설명될 수 있다. LASER201 연구결과 lazertinib 투여 시 심전도 QTc 간격 연장은 전체 용량군에서 3%, 240 mg 용량군에서 5%에서 발생하였으나 모두 1등급의 경증이었으며 임상적으로 의미 있는 좌심실 박출률의 감소는 발생하지 않았다[27]. 다만, osimertinib에 비해 lazertinib은 보다 높은 비율의 감각 이상(33%) 부작용을 보고하여 주의를 요한다(Table 1) [14,15,19,25,27,29].
EGFR exon 20의 삽입 돌연변이는 EGFR 돌연변이를 지닌 폐암 환자의 약 2-3%로 알려져 있다[30]. 그러나 유전자 증폭(polymerase chain reaction) 검사로는 차세대 염기서열분석(next-generation sequencing)대비 미검출률(51.4%)이 높은 것으로 나타나서 실제보다 과소 진단되는 경향이 있고, 정확한 유병률 파악이 쉽지 않았다. EGFR exon 20 삽입 돌연변이는 EGFR 돌연변이에 속하기는 하지만 전형적인 EGFR 돌연변이 유형은 아니며 EGFR의 C-helix 이후의 구조에 주로 아미노산 삽입이 발생하는데, 약물이 결합하는 인산화효소 부위의 구조적인 입체 장애로 인해 통상적인 EGFR-TKI의 치료 예후가 일반적인 EGFR 돌연변이 환자에 비해 좋지 않았다[30]. Amivantamab은 암세포 표면의 EGFR과 MET에 결합하여 EGFR와 MET 경로를 억제하는 이중 항체 치료제로, CHRYSALIS 1상 연구를 통해 임상 유효성을 밝혔다[31]. CHRYSALIS 연구는 EGFR exon 20 삽입 변이가 있는 비소세포폐암 환자를 대상으로 한 1상, 오픈 라벨, 다기관 연구로, 약 40%의 ORR을 보였으며 PFS, 반응지속기간(duration of response, DOR), OS의 중앙값이 각각 8.3, 11.1, 22.8개월로 보고되었다[31]. 이를 근거로 amivantamab은 백금기반 항암화학요법 치료 중 또는 치료 이후에 질병이 진행된 EGFR exon 20 삽입 돌연변이가 있는 국소 진행성 또는 전이성 비소세포폐암 환자의 치료제로 2021년 5월 FDA 승인을 받았다. 현재 amivantamab은 EGFR exon 20 삽입 돌연변이 비소세포폐암의 2차치료제로 허가를 받았지만, 다른 약제와의 병용요법으로 1차치료제로써 amivantamab을 사용하였을 때 효과가 높아지는지를 확인하는 3상 연구가 진행 중에 있다. MARIPOSA 3상 연구(Clinicaltrials.gov identifier: NCT04487080)는 이전에 치료받은 적이 없는 국소 진행성 또는 전이성 EGFR 변이 비소세포폐암 환자를 대상으로 osimertinib과 비교하여 amivantamab+lazertinib 병용요법의 효능과 효과를 연구 중인 임상연구이다. 또한 3상 연구(Clinicaltrials. gov identifier: NCT04538664) [32]는 EGFR exon 20 삽입 돌연변이가 있는 국소 진행성 또는 전이성 비소세포폐암 환자를 대상으로 carboplatin/pemetrexed 치료군을 대조군으로 amivantamab+carboplatin/pemetrexed 병용요법의 효과를 연구 중이다[32,33]. EGFR exon 20 삽입 돌연변이를 타겟으로 하는 또 다른 약제로는 mobocertinib이 있다. Mobocertinib은 임상 1/2상 연구(ClinicalTrials. gov identifier: NCT02716116) 결과를 근거로 2021년 9월 FDA 승인을 획득하였다. 이 임상연구는 이전에 백금기반 항암 치료를 받은 적이 있는 EGFR exon 20 삽입 변이가 있는 114명의 비소세포폐암 환자를 대상으로 하였으며 환자들은 mobocertinib 160 mg을 복용하였다. 연구결과 ORR은 28%로 보고되었으며, DOR과 OS 중앙값이 각각 17.5개월, 24.0개월로 확인되었다. Mobocertinib은 amivantamab과 달리 경구 약제라는 이점을 지니며, 안정성 측면에서 다른 EGFR-TKI와 유사한 것으로 확인되었으나 다른 EGFRTKI에 비하여 3등급 이상의 설사 부작용이 21%로 높게 확인되어 주의를 요한다[34].
비소세포폐암 환자에서 역형성 림프종 인산화효소(anaplastic lymphoma kinase, ALK) 유전자 돌연변이의 빈도는 약 3-7% 정도이다. 비소세포폐암 환자 중에서도 특히 비교적 젊은 비흡연자 또는 가벼운 흡연자(10갑년 미만)의 흡연력을 가진 샘암종 환자에서 빈도가 올라가는 것으로 알려져 있다[35]. 진행성 ALK 양성 비소세포폐암 환자들은 ALK 타이로신인산화효소억제제(ALK-TKI)에 매우 반응이 좋다. 진행성 ALK 양성 비소세포폐암의 1차치료제로 기존 백금기반 항암요법 대비 1세대 ALK-TKI인 크리조티닙(crizotinib)을 사용할 경우 무진행생존기간 중앙값(median PFS [mPFS], 10.9개월 대 7개월; 질병 진행 또는 사망 위험비, 0.45; P<0.001)뿐만 아니라 객관적 반응률(74% 대 45%, P<0.001) 및 1년 생존율(the probability of 1-year survival 84% 대 79%) 측면에서 유의미한 이득이 확인되었다[36]. 이 결과를 바탕으로 크리조티닙은 최초로 진행성 ALK 양성 비소세포폐암 환자의 1차치료제로 FDA 승인을 받았다. 하지만 진행성 ALK 양성 비소세포폐암 환자들은 진단 당시 뇌전이 빈도가 높고 가장 흔한 질병 진행 부위가 중추신경계인 특징이 있는데, 크리조티닙의 CNS 투과성이 좋지 않아 크리조티닙을 투여를 받는 환자에서 많게는 60%까지 뇌전이 진행이 흔하게 발생하고, 시간이 지남에 따라 크리조티닙에 대한 다양한 기전의 내성이 발생하는 것이 알려졌다. 이를 극복하기 위해 CNS 투과성이 좋고 크리조티닙 내성으로 발생하는 ALK 돌연변이에도 효과가 있는 차세대 ALK-TKI들이 개발되었다[37,38]. 진행성 ALK 양성 비소세포폐암 환자의 1차치료제로서 2세대 ALK-TKI로 알려진 세리티닙(ceritinib), 알렉티닙(alectinib), 브리가티닙(brigatinib)과 3세대 ALK-TKI로 알려진 로라티닙(lorlatinib) 모두 PFS, ORR뿐만 아니라 두개 내 반응률 측면에서 크리조티닙보다 더 우월한 효과를 보였다[37,38]. 이를 토대로 2세대 ALK-TKI (알렉티닙, 브리가티닙, 세리티닙)가 FDA 승인을 받았고, National Comprehensive Cancer Network 가이드라인에서도 진행성 ALK 양성 비소세포폐암 환자의 1차치료제로 2세대 ALK-TKI를 권고하고 있다. 3세대 ALK-TKI인 로라티닙은 초치료제로서 효과가 있을 뿐만 아니라, 1세대 및 2세대 ALK-TKI 치료 후 내성으로 인해 질병 진행이 된 경우에서도 효과가 있다(Table 2) [36-40]. 이를 토대로 우리나라에서도 2022년 9월 이후로 2세대 ALK-TKI 사용 후 질병 진행 시 로라티닙을 급여로 사용할 수 있게 허가되었다. 최근에는 절제 가능한 병기(IB-IIIA) 비소세포폐암 환자에서도 ALK 양성인 경우 더 나쁜 예후와 관련이 있는 것으로 알려지면서 수술 전 선행화학요법이나 수술 후 보조요법으로서 ALK-TKI를 활용하고자 하는 연구들도 진행중이다[36-41].
Kirsten rat sarcoma viral oncogene homologue (KRAS)변이는 폐 샘암종에서 흔한 변이 중 하나이다. 미국이나 유럽에서는 전체 폐암의 변이 중 KRAS가 20-25%를 차지하며[42], 아시아에서는 10-15%에서 KRAS 유전자 변이 비소세포폐암이 발생한다고 알려져 있다[43]. KRAS G12C 돌연변이는 비소세포폐암에서 가장 흔한 KRAS변이로, KRAS변이의 41%가 KRAS G12C 돌연변이를 가지고 있는 것으로 확인되었다[19]. KRAS는 인체 내 종양 형성에 관여하는 RAS 유전자 중 하나로서 GTPase (guanosine triphosphate)와 결합하여 세포 분화와 증식, 생존 관련 신호를 전달하는 단백질을 만든다. 이 단백질은 세포 밖에 있는 성장 신호를 핵 안으로 전달하며 GTP 활성 상태와 GDP 비활성 상태를 오가며 세포 성장을 조절하는 신호를 보낸다. KRAS G12C 돌연변이가 발생하면 활성 형태의 KRAS가 우세하게 되어 그 결과로 GTP 결합 KRAS의 농도가 비정상적으로 높아지고 세포 성장의 과활성화를 초래하여 종양세포 증식 및 성장을 유발한다[44]. 그동안 KRAS 억제제를 개발하려는 시도는 많았으나 분자생물학적 활성 메커니즘이 복잡하고 결합 부위가 작아 표적물질 개발에 어려움을 겪었다.
Sotorasib (Lumakras;Amgen)은 비활성 GDP 결합 구조에 존재하는 스위치 II 영역에 비가역적으로 결합하는 작용하는 KRAS G12C 억제제로, 처음으로 KRAS변이에 대해 FDA 승인된 약물이다. CodeBreaK 100 임상시험을 통해 37.1%의 ORR과 80.6% 질병통제율을 확인할 수 있었으며, 완전반응 및 부분반응은 각각 3.2%와 33.9%로 확인되었다. mDOR은 11.1개월, mPFS은 6.8개월이었으며, OS 중앙값은 12.5개월이었다(Table 3). 치료와 관련된 부작용은 69.8%에서 확인되었으며, 이중 grade 3 (19.8%)와 grade 4 (0.8%)의 부작용이 확인되었다. 가장 흔한 부작용은 설사(31.7%)였으며, 그 외 오심과 간 수치 증가 등이 그 뒤를 이었다[44]. 또한 최근 European Society for Medical Oncology에서 공개된 2년 장기 데이터에서는 40.7% ORR과 함께 12.3개월의 mDOR을 확인할 수 있었으며, 현재 KRAS G12C 돌연변이를 가진 치료 경력이 있는 진행성 폐암 환자에서 sotorasib과 docetaxel을 비교하기 위한 3상 연구(CodeBreaK200, ClinicalTrials. gov identifier: NCT04303780) 및 sotorasib과 다른 여러 약제들과의 병합요법에 대한 임상연구(CodeBreaK101, ClinicalTrials.gov identifier:NCT04185883)가 진행되고 있어 귀추가 주목된다(Table 3) [44].
MET는 간세포 성장인자(hepatocyte growth factor)에 대한 수용체 타이로신인산화효소(receptor tyrosine kinase, RTK)를 암호화하는 원발암유전자(proto-oncogene)이다. MET은 배아 발달, 조직 형성 및 상처 치유에 관여하며, MET 증폭(amplification)이나 점 돌연변이(point mutation)와 같은 MET의 비정상적인 활성화로 인해 신호가 조절되지 않으면 세포증식 및 혈관신생, 제어되지 않는 세포증식이 일어나 다양한 유형의 암을 촉진할 수 있다. 이러한 MET이상 중 MET 엑손 14 건너뛰기 돌연변이(MET exon 14 skipping, METΔex14)는 비소세포폐암에서 약 3%를 차지하며, 70세 이상에서 유병률이 높은 것으로 알려져 있다[45]. 폐암 중에서 MET 돌연변이는 유병률은 높지 않으나 예후가 좋지 않아 치료제 개발이 필요한 상황에서 선택적인 METTKI 제제인 캡마티닙(capmatinib)과 테포티닙(tepotinib)이 2020년과 2021년에 미국 FDA에서 METΔex14이 있는 비소세포폐암 환자의 단일 요법으로 사용하도록 승인되었다.
Capmatinib의 효능과 안전성은 2상 연구 GEOMETRY mono-1 (NCT02414139)에서 평가되었다. 총 97명의 METΔex14 비소세포폐암 환자가 모집되었으며, 과거 다른 치료를 받은 코호트(n=69)와 이전에 치료를 받지 않은 코호트(n=28)로 구성되었다[46]. 환자들은 400mg 용량의 capmatinib을 하루에 두 번 복용하였다. 연구결과 이전에 치료를 받은 환자의 2차 이상 요법으로 capmatinib을 사용한 환자군에서 ORR은 41%, mDOR은 9.7개월이었다. 치료 경험이 없는 METΔex14 환자의 ORR은 68%, mDOR은 12.6개월이었다. 가장 흔한 이상반응은 말초부종(51%) 및 오심(45%)이었으며, 이외 신장수치 증가, 호흡곤란, 알라닌 아미노기전달효소(alanine aminotransferase, ALT) 증가, 폐렴 등을 보고하였다.
Tepotinib의 효능과 안정성은 2상 연구 VISION (NCT 02864992)에서 평가되었으며, 총 152명의 METΔex14 비소세포폐암 환자가 이전 치료와 상관없이 모집되었다[47]. 환자들은 1일 1회 500 mg의 tepotinib을 복용하였다. 전체 환자에서 ORR은 46%였으며, mDOR은 11.1개월이었다. 주요 부작용은 말초부종(63%)이었으며, 오심(26%)과 설사(22%)가 그 다음으로 주요 부작용이었다.
Rearranged during transfection (RET)은 신경계 및 신장의 정상적인 배아 발달과 관련된 막관통(transmembrane) RTK를 암호화하는 유전자이다[48]. RET 융합(fusion)은 비소세포폐암 환자의 1-2%에서 발생하는 돌연변이로 주로 젊은 여성, 비흡연자 및 폐 샘암종에서 비율이 높은 것으로 알려져 있다. RET 융합 양성 비소세포폐암 환자는 뇌전이 위험이 높고 예후가 좋지 않아 유전자 특이적 표적치료제 개발의 필요성이 대두되었으며, RET 억제제인 셀퍼카티닙(selpercatinib)과 프랄세티닙(pralsetinib)이 개발되어 FDA 승인되었다.
Selpercatinib은 효능과 안정성은 1/2상 연구 LIBRETTO-001 (NCT03157128)에서 평가되었으며, 이전에 백금기반 화학 요법으로 치료를 받은 105명 환자와 치료를 받지 않은 39명 환자를 대상으로 약제 효과를 평가하였다[49]. 연구결과 이전에 치료를 받은 환자에서 ORR은 64%, mDOR은 17.5개월이었으며, 치료 경험이 없는 환자에서는 ORR 85%, mDOR은 도달하지 못하였고, 6개월 시점에서 90%에서 반응률을 보였다. 설사(48%)가 가장 흔한 부작용이었고, 구강 건조, 고혈압, 아스파트산아미노기전달효소(aspartate aminotransferase, AST) 수치 상승이 주요 부작용이었다. 3등급 부작용에는 고혈압 및 ALT 수치 증가가 포함되었다.
Pralsetinib의 효능과 안정성은 1/2상 연구 ARROW(NCT03037385)에서 평가하였으며, 이전에 치료를 받은 87명 환자와 치료를 받지 않은 27명의 환자에서 평가하였다[50]. 이전에 백금기반 화학 요법을 받은 환자의 경우 ORR은 61%였으며, DOR은 중앙값에 도달하지 못하였다. 치료 경험이 없는 환자에서 ORR은 70%였고, mDOR은 9.0개월이었다. AST 수치 상승(40%)이 가장 흔한 이상반응이었고, ALT 수치 상승, 호중구 감소증이 주요 부작용이었다. 3등급 이상의 부작용은 호중구 감소증 및 고혈압, 빈혈이 보고되었다.
Acknowledgement
This study was supported by a grant from the National Research Foundation of Korea (grant No.: NRF-2023R1A2C1003235) awarded to Yoon Soo Chang.
Figure 1.
Epidermal growth factor receptor kinase domain mutations in non-small cell lung cancer. (A) Percentage of patients with non-small cell lung cancer containing epidermal growth factor receptor (EGFR) mutations. (B) Percentage of atypical EGFR mutations observed in patients with non-small cell lung cancer. Atypical EGFR mutations are defined as non-classical, non-synonymous mutations. Adapted from Robichaux, Robichaux JP et al. Nature 2021;597:732-737, according to the Creative Commons license [11].
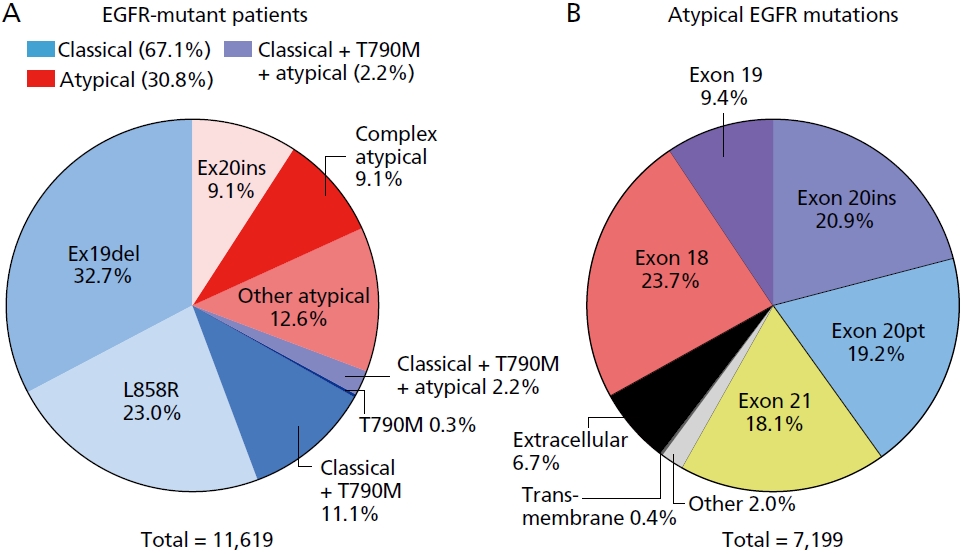
Table 1.
EGFR-TKIs in advanced EGFR-positive non-small cell lung cancer
| EGFR-TKIs | Study | mPFS (mo) | ORR (%) | mOS (mo) |
|---|---|---|---|---|
| 1st generation | ||||
| Gefitinib [14] | IPASS | 9.5 | 71.2 | 21.6 |
| Erlotinib [29] | OPTIMAL | 13.1 | 83.0 | 22.8 |
| 2nd generation | ||||
| Afatinib [15] | LUX-Lung 6 | 11.0 | 66.9 | 23.1 |
| Dacomitinib [19] | ARCHER-1050 | 14.7 | 74.9 | 34.1 |
| 3rd generation | ||||
| Osimertinib [25] | FLAURA | 18.9 | 80.0 | 38.6 |
| Lazertinib [27] | LASER201 | 11.1 | 42.0 | 38.9 |
Table 2.
ALK-TKIs in 1st line treatment in advanced ALK-positive NSCLC
| ALK-TKI | Median PFS (%, 95% CI) | ORR (%, 95% CI) | Intracranial response (%, 95% CI) |
|---|---|---|---|
| 1st generation | |||
| Crizotinib [36] | 10.9 (8.3-13.9) | 74.0 (67-81) | NA |
| 2nd generation | |||
| Alectinib [37] | 34.8 (17.7-NR) | 82.9 (75.0-88.5) | 82.9 (76.0-88.5) |
| Brigatinib [38] | 29.4 (21.2-NR) | 71 (62.0-78.0) | 78 (52.0-94.0) |
| Ceritinib [40] | 16.6 (12.6-27.2) | 72.5 (65.5-78.7) | 72.7 (49.8-89.3) |
| 3rd generation | |||
| Loratinib [39] | NR (11.4-NR) | 80 (54.8-93.0) | 64.3 (38.8-83.7) |
Table 3.
Tumor response to sotorasib therapy
| Variable | Patients (n=124) |
|---|---|
| ORR (%, 95% CI) | 37.1 (28.6-46.2) |
| DCR (%, 95% CI) | 80.6 (72.6-87.2) |
| mDOR (95% CI) | 11.1 (6.9-NE) |
| mPFS (95% CI) | 6.8 (5.1-8.2) |
| OS (95% CI) | 12.5 (10.0-NE) |
| Treatment related adverse event (n, %) | |
| Grade 1 or 2 | 62 (49.2)a) |
| Grade 3 | 25 (19.8)b) |
| Grade 4 | 1 (0.8)c) |
References
1. Statistics Korea. Causes of Death Statistics in 2020. Statistics Korea; 2021.
2. National Cancer Center. Annual report of cancer statistics in Korea in 2019. National Cancer Center; 2021.
3. Chang YS, Choi CM, Lee JC. Mechanisms of epidermal growth factor receptor tyrosine kinase inhibitor resistance and strategies to overcome resistance in lung adenocarcinoma. Tuberc Respir Dis (Seoul) 2016;79:248-256.




4. Forde PM, Spicer J, Lu S, et al. Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022;386:1973-1985.



5. Xia L, Liu Y, Wang Y. PD-1/PD-L1 blockade therapy in advanced non-small-cell lung cancer: current status and future directions. Oncologist 2019;24((Suppl 1):S31-S41.




6. Kim T, Cha YJ, Chang YS. Correlation of PD-L1 expression tested by 22C3 and SP263 in non-small cell lung cancer and its prognostic effect on EGFR mutation-positive lung adenocarcinoma. Tuberc Respir Dis (Seoul) 2020;83:51-60.




7. Choi YJ, Kim T, Kim EY, Lee SH, Kwon DS, Chang YS. Prediction model for hyperprogressive disease in non-small cell lung cancer treated with immune checkpoint inhibitors. Thorac Cancer 2020;11:2793-2803.




8. Park HJ, Lee SH, Chang YS. Recent advances in diagnostic technologies in lung cancer. Korean J Intern Med 2020;35:257-268.




9. Sharma SV, Bell DW, Settleman J, Haber DA. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007;7:169-181.



10. Kim EY, Kim A, Lee G, Lee H, Chang YS. Different mutational characteristics of the subsets of EGFR-tyrosine kinase inhibitor sensitizing mutation-positive lung adenocarcinoma. BMC Cancer 2018;18:1221.




11. Robichaux JP, Le X, Vijayan RS, et al. Structure-based classification predicts drug response in EGFR-mutant NSCLC. Nature 2021;597:732-737.




13. Kris MG, Natale RB, Herbst RS, et al. Efficacy of gefitinib, an inhibitor of the epidermal growth factor receptor tyrosine kinase, in symptomatic patients with non-small cell lung cancer: a randomized trial. JAMA 2003;290:2149-2158.


14. Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009;361:947-957.


15. Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 2014;15:213-222.


16. Yang JC, Wu YL, Schuler M, et al. Afatinib versus cisplatinbased chemotherapy for EGFR mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials. Lancet Oncol 2015;16:141-151.


17. Paz-Ares L, Tan EH, O’Byrne K, et al. Afatinib versus gefitinib in patients with EGFR mutation-positive advanced nonsmall-cell lung cancer: overall survival data from the phase IIb LUX-Lung 7 trial. Ann Oncol 2017;28:270-277.



18. Yang JC, Schuler M, Popat S, et al. Afatinib for the treatment of NSCLC harboring uncommon EGFR mutations: a database of 693 cases. J Thorac Oncol 2020;15:803-815.


19. Wu YL, Cheng Y, Zhou X, et al. Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutationpositive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol 2017;18:1454-1466.


20. Kim EY, Cho EN, Park HS, et al. Compound EGFR mutation is frequently detected with co-mutations of actionable genes and associated with poor clinical outcome in lung adenocarcinoma. Cancer Biol Ther 2016;17:237-245.




21. Zhou W, Ercan D, Chen L, et al. Novel mutant-selective EGFR kinase inhibitors against EGFR T790M. Nature 2009;462:1070-1074.




22. Cataldo VD, Gibbons DL, Pérez-Soler R, Quintás-Cardama A. Treatment of non-small-cell lung cancer with erlotinib or gefitinib. N Engl J Med 2011;364:947-955.


23. Tan CS, Cho BC, Soo RA. Next-generation epidermal growth factor receptor tyrosine kinase inhibitors in epidermal growth factor receptor -mutant non-small cell lung cancer. Lung Cancer 2016;93:59-68.


24. Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinumpemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017;376:629-640.



25. Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018;378:113-125.


26. Yun J, Hong MH, Kim SY, et al. YH25448, an irreversible EGFR-TKI with potent intracranial activity in EGFR mutant non-small cell lung cancer. Clin Cancer Res 2019;25:2575-2587.



27. Cho BC, Han JY, Kim SW, et al. A phase 1/2 study of lazertinib 240 mg in patients with advanced EGFR T790Mpositive NSCLC after previous EGFR tyrosine kinase inhibitors. J Thorac Oncol 2022;17:558-567.


28. An J, Sheikh MS. Toxicology of trastuzumab: an insight into mechanisms of cardiotoxicity. Curr Cancer Drug Targets 2019;19:400-407.


29. Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011;12:735-742.


30. Leal JL, Alexander M, Itchins M, et al. EGFR exon 20 insertion mutations: clinicopathological characteristics and treatment outcomes in advanced non-small cell lung cancer. Clin Lung Cancer 2021;22:e859-e869.


31. Park K, Haura EB, Leighl NB, et al. Amivantamab in EGFR exon 20 insertion-mutated non-small-cell lung cancer progressing on platinum chemotherapy: initial results from the CHRYSALIS Phase I Study. J Clin Oncol 2021;39:3391-3402.



32. Petrini I, Giaccone G. Amivantamab in the treatment of metastatic NSCLC: patient selection and special considerations. Onco Targets Ther 2022;15:1197-1210.




33. Lézard L. Updated Amivantamab and Lazertinib Combination Data Demonstrate Durable Responses and Clinical Activity for Osimertinib-Relapsed Patients with EGFR-Mutated Non-Small Cell Lung Cancer.
34. Zhou C, Ramalingam SS, Kim TM, et al. Treatment outcomes and safety of mobocertinib in platinum-pretreated patients with EGFR exon 20 insertion-positive metastatic non-small cell lung cancer: a phase 1/2 open-label nonrandomized clinical trial. JAMA Oncol 2021;7:e214761.



35. Chung EK, Yong SH, Lee EH, Kim EY, Chang YS, Lee SH. New targeted therapy for non-small cell lung cancer. Tuberc Respir Dis (Seoul) 2023;86:1-13.




36. Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014;371:2167-2177.


37. Peters S, Camidge DR, Shaw AT, et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med 2017;377:829-838.


38. Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib versus crizotinib in ALK-positive non-small-cell lung cancer. N Engl J Med 2018;379:2027-2039.


39. Solomon BJ, Besse B, Bauer TM, et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study. Lancet Oncol 2018;19:1654-1667.


40. Soria JC, Tan DS, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet 2017;389:917-929.


41. Lim JU. Update on adjuvant treatment in resectable non-small cell lung cancer and potential biomarkers predicting postoperative relapse. Tuberc Respir Dis (Seoul) 2023;86:14-22.




42. El Osta B, Behera M, Kim S, et al. Characteristics and outcomes of patients with metastatic KRAS-mutant lung adenocarcinomas: the lung cancer mutation consortium experience. J Thorac Oncol 2019;14:876-889.



43. Kim EY, Kim A, Kim SK, et al. KRAS oncogene substitutions in Korean NSCLC patients: clinical implication and relationship with pAKT and RalGTPases expression. Lung Cancer 2014;85:299-305.


44. Skoulidis F, Li BT, Dy GK, et al. Sotorasib for lung cancers with KRAS p.G12C mutation. N Engl J Med 2021;384:2371-2381.



45. Tan AC, Tan DS. Targeted therapies for lung cancer patients with oncogenic driver molecular alterations. J Clin Oncol 2022;40:611-625.


46. Wolf J, Seto T, Han JY, et al. Capmatinib in MET exon 14-mutated or MET-amplified non-small-cell lung cancer. N Engl J Med 2020;383:944-957.


47. Paik PK, Felip E, Veillon R, et al. Tepotinib in non-small-cell lung cancer with MET exon 14 skipping mutations. N Engl J Med 2020;383:931-943.


48. Subbiah V, Yang D, Velcheti V, Drilon A, Meric-Bernstam F. State-of-the-art strategies for targeting RET-dependent cancers. J Clin Oncol 2020;38:1209-1221.



Peer Reviewers’ Commentary
이 논문은 폐암 치료의 근간이 되는 표적치료제의 종류와 기전에 대하여 최신 문헌을 정리하여 설명하고 있다. 현재 폐암의 치료에 있어서 표적치료제는 매우 중요한 위치에 있으며, 폐암을 진단할 때 표적치료제가 가능한 돌연변이를 찾는 검사방법은 필수적이다. 이 논문은 폐암에서 대표적인 돌연변이들과 관련한 주요 연구 결과를 소개하고, 각 돌연변이에 따른 폐암의 표적치료제와 부작용에 대해서 잘 정리하여 기술하고 있다. 이 논문은 비소세포폐암 치료에 사용되는 표적치료제의 내성 기전을 이해하기 쉽도록 잘 설명하고 있어, 폐암 치료의 현재 위치와 이후 방향에 대하여 이해하는 데 많은 도움이 될 것이며, 폐암 환자를 진료하는 임상 현장에 많은 도움이 될 것으로 판단된다.
[정리: 편집위원회]
-
METRICS

-
- 1 Web of Science
- 0 Crossref
- Scopus
- 3,315 View
- 262 Download
-
Related articles in
J Korean Med Assoc -
Adjuvant treatment for resectable non-small cell lung cancer2023 March;66(3)
All-round counterattack to conquer lung cancer2023 March;66(3)
Radiotherapy for Locally Advanced Lung Cancer2003 January;46(1)
Molecular Targeted Therapy for Lung Cancer2003 January;46(1)






