 |
 |
- Search
| J Korean Med Assoc > Volume 66(6); 2023 > Article |
|
Abstract
Background: Biomarkers are used in diverse clinical fields, including oncological, cardiovascular, infectious, and rheumatoid diseases. In infectious diseases, biomarkers are widely used for identifying fever due to infection, evaluating the possibility of progression to sepsis, predicting prognosis, estimating treatment response, and determining the timing of discontinuation of antibiotic treatment. Thus, biomarkers are used as indicators that can inform clinical decisions.
Current Concepts: Biomarkers for infectious diseases typically relate to inflammatory processes in, which are activated by external antigens. Historically, research has focused on acute phase reactants; however, more recently, various inflammatory response biomarkers have been investigated.
Discussion and Conclusion: To date, no infallible biomarker has been identified for infectious diseases. The main reasons are the potential for these molecules to also be affected by non-infectious causes and the individual differences in the degree of change of the biomarker. Although diagnosis and clinical decisions cannot depend on biomarkers alone, these are undoubtedly essential tools in clinical contexts, if thoroughly and carefully characterized. Here, we review several substances used or showing significant potential as biomarkers for infectious diseases.
Current Concepts: Biomarkers for infectious diseases typically relate to inflammatory processes in, which are activated by external antigens. Historically, research has focused on acute phase reactants; however, more recently, various inflammatory response biomarkers have been investigated.
Discussion and Conclusion: To date, no infallible biomarker has been identified for infectious diseases. The main reasons are the potential for these molecules to also be affected by non-infectious causes and the individual differences in the degree of change of the biomarker. Although diagnosis and clinical decisions cannot depend on biomarkers alone, these are undoubtedly essential tools in clinical contexts, if thoroughly and carefully characterized. Here, we review several substances used or showing significant potential as biomarkers for infectious diseases.
1998년 미국국립보건원(National Institutes of Health; NIH)의 생물표지자(biomarker) 정의 그룹(Biomarkers Definitions Working Group)에서는 생물표지자를 “객관적으로 측정 및 평가될 수 있는 특징이 있는, 정상적인 생물학적 과정이나 병원성(pathogenic) 과정 또는 치료적 처치에 대한 약리학적 반응의 지표”라 정의하였다[1].
이러한 생물표지자는 종양, 심혈관질환, 감염질환이나 류마티스 질환과 같은 의학의 여러 분야에서 사용되고 있다. 특히 감염질환에 있어서는 감염 여부에 대한 감별에서부터 패혈증으로의 진행 가능성이나 예후 판단, 치료 반응 평가, 항생제 치료의 중단 시점 결정에 이르기까지 폭 넓게 이용되며 판단에 중요 근거로 활용된다.
현재까지 약 250개 이상의 생물표지자로서의 가능성이 있는 다양한 후보들이 제시되어 왔지만, 감염질환에 있어 좋은 생물표지자가 갖추어야 하는 조건들을 충족하는 것들은 많지 않다. 기본적으로 환자에게 감염이 발생하지 않은 경우에는 낮은 수치를 보여야 하며, 감염이 발생한 경우 임상 양상과 체내 생물표지자의 수치가 상관관계를 보여야 하기 때문에 치료 반응과 수치의 추이가 일치해야 한다[2].
이러한 조건을 충족하기가 쉽지 않기 때문에 발견된 지 거의 1세기가 지난 C반응단백질(C-reactive protein, CRP)과 같은 고전적인 생물표지자가 아직까지 새로운 물질로 대체되지 않고 지금까지도 감염질환에서의 대표적인 마커로서 유지되고 있다[3,4].
또한 이러한 CRP를 비롯하여 생물표지자들이 비감염성 원인에 의한 영향을 받으며 수치의 변화 정도에도 개인차이가 존재하기 때문에 현재까지 이상적이고 완벽한 생물표지자는 없는 실정이다. 따라서 생물표지자 단독만으로 진단 및 판단을 할 수는 없지만, 각 생물표지자의 특성을 이해하여 활용한다면 분명 중요한 도구가 된다. 이 논문에서는 감염 질환과 관련하여 사용되고 있거나 생물표지자로서의 유의한 잠재성을 보이는 후보 물질 중 일부를 소개한다.
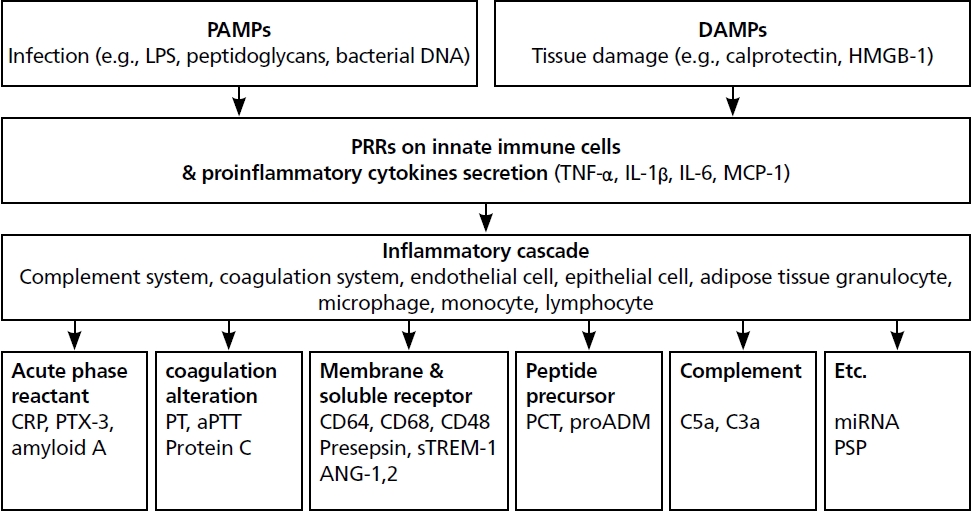
감염질환의 생물표지자는 대개 외부 항원에 대해 인체의 면역계가 반응하는 일련의 과정과 관련이 있다(Figure 1). 병원체의 lipopolysaccharide (LPS), peptidoglycan과 같은 내독소(endotoxin)인 pathogenassociated molecular patterns나 조직 손상에 의해 숙주 세포에서 분비되는 damage-associated molecular patterns가 선천면역세포의 패턴인식수용체(pattern-recognition receptors)에 인식되면 종양괴사인자(tumor necrosis factor, [TNF])-α, 인터루킨(interleukin [IL])-1β, IL-6와 같은 전염증성 사이토카인(proinflammatory cytokines)을 분비하게 된다. 이후 cytokine cascade에 따라 선천 면역을 증폭 또는 조절함으로써 소위 염증성 반응이라 하는 일련의 과정이 이어지게 되고, 그 과정에서 acute phase reactant나 다른 사이토카인들이 생성된다. 감염질환에서 활용되는 대부분의 생물표지자들은 이 과정에서 증가 또는 감소하는 물질들로 구성되어 있다[5]. 염증성 반응과 관련한 몇 가지 카테고리에 따라 생물표지자를 분류하면 다음과 같다.
Calprotectin은 호중구와 대식세포의 세포질에 다량 존재하면서 세포가 스트레스나 손상을 받게 되거나, 세균 또는 세균의 내독소에 반응하는 경우 IL-6 비의존성 경로를 거쳐 분비된다. 따라서 세균 감염 발생 시 수 시간 이내부터 빠르게 증가를 보여주기 때문에 초기에 세균 감염 여부 평가에 도움이 될 가능성이 있으며, 초기 패혈증 진단에 대한 가능성을 보여주는 연구들이 일부 있으나 n수가 제한적이다[6,7]. 아직까지 calprotectin은 염증성 장질환에 대한 생물 표지자로서의 보고가 많으며, 감염질환에 대해서는 신생아를 대상으로 한 연구가 주를 이룬다[8].
High-mobility group box 1 protein (HMGB-1)은 핵 내에서는 DNA 결합 단백질로서 전사 조절을 통해 유전자 발현을 조절하는 역할을 하는 것으로 알려져 왔다. 그런데 최근 들어 손상되거나 죽은 세포 또는 활성화된 호중구와 단핵 세포를 통해 세포 외로 분비되어 감염을 포함한 염증성 반응에 기여하는 것이 밝혀지면서 후속 연구들을 통해 패혈증, 출혈로 인한 쇼크, 류마티스 관절염과 같은 여러 염증 상태에서 상승하는 것으로 확인되고 있다[9]. HMGB-1를 대상으로 진행한 연구결과에서는 대체적으로 패혈증에 대한 예측에는 도움이 될 수 있지만 패혈증의 예후 인자로서의 역할에 대해서는 연구들마다 상이하여 논란이 있다[10,11].
C반응단백질은 pentraxin-1으로도 불리며, 짧은 형태의 고리형 오각형태인 펜트렉신(pentraxin)의 구조를 가지고 있다. CRP는 염증 반응이 개시되면서 분비되는 IL-6에 의해 간에서 생성이 촉진되는 대표적인 비특이적 acute phase protein으로 아직까지 급성 염증 상태에서의 역할이 명확히 밝혀지지는 않았으나 병원체의 인지질에 부착함으로써 병원체에 대한 선천 면역반응을 증진시킬 것이라 보고 있다[3].
오랫동안 사용된 생물표지자인만큼 CRP에 대해 많은 선행 연구들이 있다. 일부 상이한 결과들도 있지만, 대체적으로 CRP가 세균 감염과 바이러스 감염의 감별과[12] 패혈증의 진단에 도움이 되겠으나[13], 감염 외 다른 염증 상태를 감별하기에는 낮은 특이도를 보인다[14]. 낮은 특이도를 보이는 것은 CRP가 수술, 화상, 동맥경화가 있거나 심근경색이나 류마티스 질환과 같은 감염 외의 모든 염증에 대해서도 비특이적인 상승을 보이며 간세포로부터 합성되기 때문에 간질환이 있는 경우 일반적인 증가, 감소와 다른 양상을 보일 수 있으므로 해석에 주의가 필요한 마커이기 때문이다[15]. 따라서 CRP는 감염질환에 대해 진단적인 목적의 사용으로는 유의가 필요하지만 감염질환의 치료 반응에 대한 평가나 패혈증의 초기 발현에 대한 스크리닝 목적으로 유용하게 사용될 수 있다[14].
Pentraxin-3 (PTX-3)는 펜트렉신 형태의 도메인으로 구성된 acute phase reactant로서 단핵구, 대식세포, 수지상세포나 혈관, 림프 내피세포, 버팀질세포(stromal cells)의 톨유사수용체(Toll-like receptor, TLR)가 신호를 받아 분비되거나[16], 중성구가 락토페린을 가진 과립에 저장해둔 PTX-3가 IL-1나 TNF와 같은 전염증성 사이토카인에 의해, 또는 다양한 타입의 미생물 구조 인식에 대해 반응하여 분비된다[17]. 특히 염증성 자극에 대해 CRP보다 더 빠르게 상승을 보이는 것으로 알려졌는데, 이는 중성구에서 이미 만들어져 과립 내에 저장되어 있던 PTX-3이 자극에 따라 분비되는 것이기 때문에 반응이 빠른 것으로 보인다. 또한 PTX-3는 다양한 세포 외 물질 분자와 작용하여 바탕질(matrix)의 재구성과 수선에 관여한다[18]. 이러한 PTX-3에 대한 리뷰 분석에 따르면 PTX-3 레벨이 패혈증의 중증도나 불량한 예후와의 관련성이 확인되고 있는데 cut-off value 설정에는 연구결과마다 상이함이 있다[19,20].
CD68은 주로 대식세포나 다른 단핵구에서 주로 발견되는 당단백으로 이전까지는 주로 염증성 또는 암 병변 조직과 같은 영역에서 의미 있는 마커로 인식되었지만 최근 들어 뇌 속 신경교세포의 활성과 관련 있는 것으로 보이며, 패혈증으로 인해 사망한 사람들의 신경교세포에서 CD68 발현이 증가되어 있음이 확인된 바 있어 패혈증의 중증 및 예후에 대한 아이디어를 줄 수 있으나 적용으로는 아직 이른 감이 있다[25].
Presepsin은 CD14의 N-말단쪽 절편으로 단핵구나 대식세포의 LPS 결합 단백질(LPS binding protein, LPB)이 LPS와 결합함으로써 발생한 일련의 cascade에 의해 CD14에서 떨어져 나오게 되어 분비되는 것으로 soluble CD14 fragment으로 불리기도 한다[26,27]. 패혈증 그룹과 감염을 동반하지 않은 전신염증반응증후군(systemic inflammatory response syndrome, SIRS) 그룹에서의 presepsin 레벨을 비교한 한 연구에서, presepsin 레벨이 패혈증 그룹에서 중증도에 따라 더 높게 상승하는 것을 확인하였다. 또한 같은 연구에서 그람 양성균과 음성균 감염에 따라 presepsin의 상승에 유의한 차이를 보고하여 그람 양성균과 음성균 감염을 구분하는 마커로서의 잠재성을 보고한 연구가 있지만 이에 대해서는 샘플 수가 적고 다소 논란이 있다[26].
Soluble trigger receptor expressed in the myeloid cell-1 (sTREM-1)은 TREM군 중 하나로 혈장뿐 아니라 흉수, 가래 그리고 소변에 이르기까지 다양한 검체에서 측정될 수 있다. TREM-1은 중성구와 단핵구와 같은 일부 골수성 세포들의 막사이에 존재하는 당단백으로 비감염 상태에서는 잘 발현되지 않지만, 세균의 LPS에 노출되거나 선천 면역 반응이 활성되면서 DNA-activating protein 12 신호 경로를 경유하여 그 발현이 증가한다[28].
Procalcitonin (PCT)은 칼시토닌의 전구체로서 정상적으로 갑상선에서 만들어지며 매우 낮은 레벨로 혈중에 존재한다. 그러나 감염 상태, 특히 세균의 병독소에 노출되는 경우 갑상선 외의 폐, 간, 신장, 췌장이나 지방 조직 등 다른 조직에서도 만들어지면서 비교적 빠른 시간내에 혈장에서 레벨이 증가하게 되고, 감염질환이 호전되면서 빠르게 감소하는 경향을 보이는데, 신기능 저하 시에는 PCT의 반감기가 길어지므로 좀더 천천히 감소한다[31,32]. 선행 연구들에 의하면 PCT가 CRP에 비해 입원 환자의 세균 감염에 대해 좀 더 높은 특이도를 보이며[14], 항생제 투약 시작, 그리고 중단 시점을 결정할 때에 사용할 수 있다[33]. 다기관, 전향적으로 진행한 PRORATA trial을 참고하면 PCT를 가이드로 항생제 중단시점을 결정하는 것이 예후의 열등성을 보이지 않으면서도 항생제 투약기간을 줄일 수 있었으며[34], 이를 바탕으로 국내에서 제시된 consensus 알고리즘에 따르면 PCT 레벨이 0.5 μg/L 미만이거나 최고 수치의 80% 이상 감소하는 경우 중단을 고려하도록 한다[35,36]. 단, 시행된 연구들이 대부분 패혈증과 하기도 감염에 대해 진행되었다는 점이 있으며, 실제 감염이 있더라도 농양과 같이 국소화된 경우에는 위음성을 보일 수도 있는 점에 대해 고려가 필요하다.
Adrenomedullin (ADM)이란 주로 내피세포나 혈관의 평활근에서 생성되는 펩타이드이며 다양한 조직에서 만들어진다. ADM은 혈관 확장이나 autocrine/paracrine vasoactivator로 작용함으로써 전신적 순환 조절에 관여하며 패혈증 또는 패혈쇼크에서 증가하므로 중요한 생물표지자로서의 가능성이 있지만 반감기가 약 22분 정도로 짧아 빠르게 분해되기 때문에 신뢰성 있는 측정이 용이하지 못하였다. 대신 ADM의 전구체인 mid regional fragment of pro-ADM(MR-proADM)은 훨씬 안정성이 있고 ADM에 대한 surrogate marker로 충분할 만큼 체내 ADM 레벨을 반영하기 때문에 MR-proADM을 이용한 몇 가지 연구들이 진행되었다[37,38]. 해당 연구들에 따르면, MR-proADM은 SIRS에 비해 패혈증에서 유의하게 더 높은 수치로 상승하였다. 또한 패혈증과 비교시 패혈성 쇼크에서도 더 높은 경향을 보여주었으며, 패혈증 또는 패혈쇼크에서 생존자와 사망자에도 유의한 차이를 보여 진단 및 예후 판단에 도움이 될 것으로 보인다[39]. MR-proADM이 염증 반응과 관련한 물질이기 보다는 내피세포나 혈관 평활근에서 분비되는 물질이므로 고혈압, 심부전이나 심근경색, 신질환이나 당뇨, 급 성기 뇌경색에서도 일부 상승을 보이는 면이 있어 좀 더 적극적인 생물표지자로 사용되기 위해서는 cut-off 설정이 중요하다[37].
최근에는 이중 항체 샌드위치 효소 결합 면역흡착분석법(Double Antibody Sandwich-ELISA)이 개발되면서 C-terminally amidated biologically active ADM (bio-ADM)을 측정할 수 있게 되었으며, 2020년 발표된 한 연구에서는 중환자실로 입원한 패혈증 환자의 입원 당시 측정한 bio-ADM의 레벨이 30일 사망률과 장기부전과 유의한 관련이 있다는 보고를 한 바 있다[40].
Angiopoietin (ANG)-1과 ANG-2는 내피세포에서 유래되며 내피세포에 특이적인 Tie2 수용체에 대한 리간드로, Tie2 수용체가 활성화되면 혈관 안정성이나 내피세포의 방어벽 기능과 관련한 일련의 신호체계가 작동되며 NF-Κb를 억제함으로써 항염증 작용을 하게 된다. ANG-1과 ANG-2는 Tie2 수용체에 대해 경쟁적으로 작용하며 그 작용도 상반된다. ANG-1은 내피를 안정화시키는 방향으로 가는 반면 ANG-2는 내피세포나 혈관의 안정성이 감소하는 방향으로 작용하며 염증 반응을 유도하는 중요한 역할을 한다[41]. 그러다 보니 패혈증 관련한 연구에서의 ANG-1과 ANG-2의 수치 변화 역시 상반되게 나타나는 경향을 보인다. 중증 패혈증 환자에서 ANG-2/ANG-1의 비가 생존자 그룹에 비해 사망자 그룹에서 유의하게 높게 확인되고[42], SIRS 그룹에서 진행한 연구지만 28일 사망 여부 기준으로 ANG-1은 생존자 그룹에서 높게 나타났으나 ANG-2은 사망자 그룹에서 높게 나타났다[43]. 현재까지 보고된 연구들에서 ANG-1, 2는 주로 예후와 유의한 연관성을 보이고 있어 진단 목적보다는 예후 판단에 더 적합하게 적용될 것으로 보인다.
micro RNAs (miRNAs)는 특정한 단백질이 코딩되어 있지 않은(non-coding) RNA로 일부는 mRNA의 silence, 또는 전사 전이나 후에 관여하여 발현을 조절한다. 그러나 또 다른 일부는 세포질에서 분해되거나 조직의 손상이나 괴사와 같은 특정 상황에서는 미세 소포나 엑소좀의 형태로 세포 밖으로 분비되어 특정 단백질에 결합하면서 염증과 같은 상태부터 종양, 심혈관질환 등 다양한 상태에 대한 신호 경로에 관여하게 되며, 특히 감염에 대해서는 TLR-4 신호에 작용하여 전염증성 사이토카인 분비에도 관여할 것으로 보인다. 이러한 형태의 miRNAs는 세포 밖에서도 안정성을 가지고 있어 다양한 상태 또는 질환에 대한 생물표지자로서의 잠재력을 가지고 있으며, 패혈증에 대해서도 연구가 진행되고 있다[44,45] TNF-α, IL-10, IL-18과 같은 사이토카인의 레벨과 miR-150의 발현 정도가 연관성이 있다는 보고에서부터[46], 최근에는 보고된 miR-125a, b에 대한 연구에서는 miR 125a는 패혈증으로의 진행 위험성과 사망률 증가와 관련이 있었고 miR-125b는 패혈증 환자의 사망률 증가와 관련성을 보였다[47].
Lithostathine으로도 알려져 있는 pancreatic stone protein (PSP)는 칼슘 의존성의 글리칸 부착성(glycanbinding) 단백질로 췌장의 acinar 세포와 장의 Paneth 세포에서 만들어지며, 만성 췌장염, 만성 신부전이나 소화기계 암에서 상승을 보일 뿐 아니라 패혈증과 손상에서도 상승이 확인되었다. PSP는 다양한 범위의 기능이 있는 것으로 보이는데 in vitro 상에서는 접합(adhesion)이나 항상성, 선천 면역과 관련한 신호전달에도 관여하는 것으로 보인다[48]. 생물표지자로서의 가능성에 대해 시행한 몇 가지 연구들에서, 분류되지 않은 중증 환자에서 PSP가 PCT나 다른 생물표지자인 soluble CD25나 heparin-binding protein 보다 감염의 동반이나 패혈증에 대한 진단에 유리함을 보여주었고, 심각한 화상 환자들에게서 패혈증이 발생하는 경우 PSP의 증가가 확인되었다[49]. 또한 다기관에서 전향적으로 원내 감염에 의한 패혈증 환자들을 대상으로 시행한 한 연구에서는 임상적으로 패혈증을 진단하기 전에 PCT는 약 3일 전부터, 그리고 CRP는 약 2일 전부터 상승을 보이는데 PSP는 약 5일 전부터 상승을 보이기 시작하여 감염질환 또는 패혈증으로의 이행에 대한 조기 발견에 도움이 될 수 있음을 보여주었다[50].
감염질환에 대해 생물표지자는 중증도에 관계없이 다양하게 이용될 수 있다. 경증 상태이거나 발열과 같은 모호한 징후를 보이는 경우 감염이 동반되어 있을 가능성, 항생제 치료의 계시 여부에 대한 판단에서부터 치료 반응 평가, 항생제 치료 종료에 이르기까지 일련의 치료 과정에 도움을 줄 수 있는가 하면 중등증 이상의 환자의 경우에는 패혈증으로의 이행 또는 패혈성 쇼크의 가능성, 그리고 예후를 판단하는 데에 도움을 줄 수 있다. 더 빠르고 감염에 특이적인 생물표지자를 기대하며 수많은 생물표지자가 연구되고 있으나 염증 반응 자체에도 개인차이가 있듯이 생물표지자의 변화에도 여러 변수가 작용하기 때문에 절대적인 진단보다는 보조적인 도구로의 사용이 적합할 것이다. 또한 본문에서 살펴본 생물표지자들을 포함하여 각 특성에 따라 제한점도 있기때문에 생물표지자를 효과적으로 이용하기 위해서는 이에 대한 충분한 이해가 선행되어야 한다.
Figure 1.
A schematic diagram of the initial response of the human immune system. Illustrated by the author. PAMP, pathogen-associated molecular pattern; LPS, lipopolysaccharide; DAMP, damage-associated molecular pattern; HMGB-1, high-mobility group box 1 protein; PRR, pattern-recognition receptor; TNF, tumor necrosis factor; IL, interleukin; MCP-1, monocyte chemoattractant protein-1; CRP, C-reactive protein; PTX-3, pentraxin- 3; PT, prothrombin time; aPTT, activated partial thromboplastin time; sTREM-1, soluble trigger receptor expressed in the myeloid cell-1; ANG, angiopoietin; PCT, procalcitonin; ADM, adrenomedullin; miRNA, micro RNA; PSP, pancreatic stone protein.
References
2. Póvoa P, Coelho L. Which biomarkers can be used as diagnostic tools for infection in suspected sepsis? Semin Respir Crit Care Med 2021;42:662-671.


3. Mantovani A, Garlanda C. Humoral innate immunity and acute-phase proteins. N Engl J Med 2023;388:439-452.



4. Kim CJ. Current status of antibiotic stewardship and the role of biomarkers in antibiotic stewardship programs. Infect Chemother 2022;54:674-698.




5. Barichello T, Generoso JS, Singer M, Dal-Pizzol F. Biomarkers for sepsis: more than just fever and leukocytosis-a narrative review. Crit Care 2022;26:14.




6. Larsson A, Tydén J, Johansson J, et al. Calprotectin is superior to procalcitonin as a sepsis marker and predictor of 30-day mortality in intensive care patients. Scand J Clin Lab Invest 2020;80:156-161.


7. Simm M, Söderberg E, Larsson A, et al. Performance of plasma calprotectin as a biomarker of early sepsis: a pilot study. Biomark Med 2016;10:811-818.


8. Decembrino L, De Amici M, Pozzi M, De Silvestri A, Stronati M. Serum calprotectin: a potential biomarker for neonatal sepsis. J Immunol Res 2015;2015:147973.




9. Chen G, Li J, Ochani M, et al. Bacterial endotoxin stimulates macrophages to release HMGB1 partly through CD14- and TNF-dependent mechanisms. J Leukoc Biol 2004;76:994-1001.



10. Karlsson S, Pettilä V, Tenhunen J, Laru-Sompa R, Hynninen M, Ruokonen E. HMGB1 as a predictor of organ dysfunction and outcome in patients with severe sepsis. Intensive Care Med 2008;34:1046-1053.



11. Yoo H, Im Y, Ko RE, Lee JY, Park J, Jeon K. Association of plasma level of high-mobility group box-1 with necroptosis and sepsis outcomes. Sci Rep 2021;11:9512.




12. Jeon JS, Rheem I, Kim JK. C-reactive protein and respiratory viral infection. Korean J Clin Lab Sci 2017;49:15-21.

15. Simon L, Gauvin F, Amre DK, Saint-Louis P, Lacroix J. Serum procalcitonin and C-reactive protein levels as markers of bacterial infection: a systematic review and meta-analysis. Clin Infect Dis 2004;39:206-217.


16. Garlanda C, Bottazzi B, Magrini E, Inforzato A, Mantovani A. PTX3, a humoral pattern recognition molecule, in innate immunity, tissue repair, and cancer. Physiol Rev 2018;98:623-639.


17. Jaillon S, Peri G, Delneste Y, et al. The humoral pattern recognition receptor PTX3 is stored in neutrophil granules and localizes in extracellular traps. J Exp Med 2007;204:793-804.




18. Doni A, Musso T, Morone D, et al. An acidic microenvironment sets the humoral pattern recognition molecule PTX3 in a tissue repair mode. J Exp Med 2015;212:905-925.




19. Caironi P, Masson S, Mauri T, et al. Pentraxin 3 in patients with severe sepsis or shock: the ALBIOS trial. Eur J Clin Invest 2017;47:73-83.



20. Lee YT, Gong M, Chau A, et al. Pentraxin-3 as a marker of sepsis severity and predictor of mortality outcomes: a systematic review and meta-analysis. J Infect 2018;76:1-10.


21. Shah C, Hari-Dass R, Raynes JG. Serum amyloid A is an innate immune opsonin for Gram-negative bacteria. Blood 2006;108:1751-1757.



22. Arnon S, Litmanovitz I, Regev RH, Bauer S, Shainkin-Kestenbaum R, Dolfin T. Serum amyloid A: an early and accurate marker of neonatal early-onset sepsis. J Perinatol 2007;27:297-302.



23. Icardi M, Erickson Y, Kilborn S, Stewart B, Grief B, Scharnweber G. CD64 index provides simple and predictive testing for detection and monitoring of sepsis and bacterial infection in hospital patients. J Clin Microbiol 2009;47:3914-3919.




24. Yin WP, Li JB, Zheng XF, An L, Shao H, Li CS. Effect of neutrophil CD64 for diagnosing sepsis in emergency department. World J Emerg Med 2020;11:79-86.



25. Chistiakov DA, Killingsworth MC, Myasoedova VA, Orekhov AN, Bobryshev YV. CD68/macrosialin: not just a histochemical marker. Lab Invest 2017;97:4-13.


26. Lu B, Zhang Y, Li C, et al. The utility of presepsin in diagnosis and risk stratification for the emergency patients with sepsis. Am J Emerg Med 2018;36:1341-1345.


28. Cao C, Gu J, Zhang J. Soluble triggering receptor expressed on myeloid cell-1 (sTREM-1): a potential biomarker for the diagnosis of infectious diseases. Front Med 2017;11:169-177.



29. Aksaray S, Alagoz P, Inan A, Cevan S, Ozgultekin A. Diagnostic value of sTREM-1 and procalcitonin levels in the early diagnosis of sepsis. North Clin Istanb 2017;3:175-182.



30. Brenner T, Uhle F, Fleming T, et al. Soluble TREM-1 as a diagnostic and prognostic biomarker in patients with septic shock: an observational clinical study. Biomarkers 2017;22:63-69.


31. Assicot M, Gendrel D, Carsin H, Raymond J, Guilbaud J, Bohuon C. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet 1993;341:515-518.



32. Becker KL, Snider R, Nylen ES. Procalcitonin assay in systemic inflammation, infection, and sepsis: clinical utility and limitations. Crit Care Med 2008;36:941-952.


33. Christ-Crain M, Jaccard-Stolz D, Bingisser R, et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: clusterrandomised, single-blinded intervention trial. Lancet 2004;363:600-607.


34. Bouadma L, Luyt CE, Tubach F, et al. Use of procalcitonin to reduce patients' exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet 2010;375:463-474.


35. Park DW, Choi JY, Kim CJ, Kim JH, Kim HB, Lee DG. Implementation of procalcitonin in antibiotic stewardship: derivation of a consensus algorithm for procalcitonin use in clinical practice. Infect Chemother 2022;54:621-636.




36. Kim JH. Clinical utility of procalcitonin on antibiotic stewardship: a narrative review. Infect Chemother 2022;54:610-620.




37. Koyama T, Kuriyama N, Suzuki Y, et al. Mid-regional proadrenomedullin is a novel biomarker for arterial stiffness as the criterion for vascular failure in a cross-sectional study. Sci Rep 2021;11:305.




38. Viaggi B, Poole D, Tujjar O, Marchiani S, Ognibene A, Finazzi S. Mid regional pro-adrenomedullin for the prediction of organ failure in infection. Results from a single centre study. PLoS One 2018;13:e0201491.



39. Andaluz-Ojeda D, Nguyen HB, Meunier-Beillard N, et al. Superior accuracy of mid-regional proadrenomedullin for mortality prediction in sepsis with varying levels of illness severity. Ann Intensive Care 2017;7:15.




40. Lundberg OH, Lengquist M, Spångfors M, et al. Circulating bioactive adrenomedullin as a marker of sepsis, septic shock and critical illness. Crit Care 2020;24:636.




41. David S, Kümpers P, van Slyke P, Parikh SM. Mending leaky blood vessels: the angiopoietin-Tie2 pathway in sepsis. J Pharmacol Exp Ther 2013;345:2-6.


42. Fang Y, Li C, Shao R, Yu H, Zhang Q. The role of biomarkers of endothelial activation in predicting morbidity and mortality in patients with severe sepsis and septic shock in intensive care: a prospective observational study. Thromb Res 2018;171:149-154.


43. Mikacenic C, Hahn WO, Price BL, et al. Biomarkers of endothelial activation are associated with poor outcome in critical illness. PLoS One 2015;10:e0141251.



44. Inui M, Martello G, Piccolo S. MicroRNA control of signal transduction. Nat Rev Mol Cell Biol 2010;11:252-263.



45. Condrat CE, Thompson DC, Barbu MG, et al. miRNAs as biomarkers in disease: latest findings regarding their role in diagnosis and prognosis. Cells 2020;9:276.



46. Vasilescu C, Rossi S, Shimizu M, et al. MicroRNA fingerprints identify miR-150 as a plasma prognostic marker in patients with sepsis. PLoS One 2009;4:e7405.



47. Zhu X. MiR-125b but not miR-125a is upregulated and exhibits a trend to correlate with enhanced disease severity, inflammation, and increased mortality in sepsis patients. J Clin Lab Anal 2020;34:e23094.



48. Eggimann P, Que YA, Rebeaud F. Measurement of pancreatic stone protein in the identification and management of sepsis. Biomark Med 2019;13:1.


Peer Reviewers’ Commentary
이 논문은 감염질환의 진단에 유용하게 사용되고 있는 바이오마커와 향후 바이오마커로서의 유의한 잠재성을 보이는 후보 물질들에 대해 최신 문헌을 체계적으로 정리해 소개하고 있다. 바이오마커는 감염질환에 있어서 감별진단, 치료 효과, 그리고 예후관련 평가에 있어서 유용하게 사용되는 도구이다. 바이오마커는 각각의 특징에 따라서 감염질환에 의한 염증 반응에 따른 변화의 차이가 있으므로, 바이오마커의 변화 정도에도 차이가 있을 수 있다. 따라서, 효율적인 바이오마커의 사용과 해석을 위해서는 바이오마커의 올바른 이해가 필요하다. 이 논문은 바이오마커 각각의 특징과 장점 및 제한점 등을 잘 정리하여 기술하고 있어, 감염질환의 진단, 치료, 예후 평가에 있어서 바이오마커의 중요성을 이해하는 데 큰 도움을 줄 것이고, 바이오마커의 연구에도 많은 도움이 될 것으로 판단된다.
[정리: 편집위원회]
-
METRICS

-
- 0 Crossref
- Scopus
- 1,481 View
- 234 Download
-
Related articles in
J Korean Med Assoc -
Natural Tissues as Biomaterials1997 April;40(4)
Non-Infectious Diseases Causing Fever of Unknown Origin1998 January;41(1)
Infectious Disease Prevention for Travelers2005 August;48(8)
Infectious Diseases among Healthcare Workers2010 June;53(6)
Global Epidemiology of Infectious Diseases and Travel Medicine2010 June;53(6)






