 |
 |
- Search
| J Korean Med Assoc > Volume 67(2); 2024 > Article |
|
Abstract
Background: Esophageal cancer was the seventh most common cancer worldwide in 2020 and the sixth leading cause of cancer-related deaths (544,000 deaths annually), accounting for one-eighteenth of all cancer-related deaths. In Korea, esophageal cancer accounted for 1.0% of all cancer cases, with 2,483 cases diagnosed in 2017, making it the fifteenth most common cancer and the eleventh most common cause of cancer-related deaths.
Current Concepts: Esophageal squamous cell cancer (ESCC) is the most prevalent pathology (91.2%) in Korea, typically affecting the upper and middle esophagus. The common causes of ESCC are smoking, drinking, and hot beverages. ESCC lesions confined to the mucosa, such as cTis and cT1a, can be treated with endoscopic resection, but lesions invading the submucosa require esophagectomy. Patients with locally advanced ESCC with lymph node metastasis require neoadjuvant therapy followed by esophagectomy and reconstruction. Esophagectomy is associated with mortality and morbidity rates of 3% and 50%, respectively.
Discussion and Conclusion: ESCC is associated with a poorer prognosis compared to those associated with other cancers, and the high mortality and morbidity rates associated with esophagectomy often lead to hesitation toward aggressive treatments. However, recent advances in chemotherapy, radiation therapy, and surgery can offer hope for a cure. Minimally invasive esophagectomy may reduce the rate of fatal complications. The shift from traditional platinum-based chemotherapy to immune checkpoint inhibitors also suggests promise for the treatment outcomes of ESCC.
Current Concepts: Esophageal squamous cell cancer (ESCC) is the most prevalent pathology (91.2%) in Korea, typically affecting the upper and middle esophagus. The common causes of ESCC are smoking, drinking, and hot beverages. ESCC lesions confined to the mucosa, such as cTis and cT1a, can be treated with endoscopic resection, but lesions invading the submucosa require esophagectomy. Patients with locally advanced ESCC with lymph node metastasis require neoadjuvant therapy followed by esophagectomy and reconstruction. Esophagectomy is associated with mortality and morbidity rates of 3% and 50%, respectively.
Discussion and Conclusion: ESCC is associated with a poorer prognosis compared to those associated with other cancers, and the high mortality and morbidity rates associated with esophagectomy often lead to hesitation toward aggressive treatments. However, recent advances in chemotherapy, radiation therapy, and surgery can offer hope for a cure. Minimally invasive esophagectomy may reduce the rate of fatal complications. The shift from traditional platinum-based chemotherapy to immune checkpoint inhibitors also suggests promise for the treatment outcomes of ESCC.
식도암(esophageal cancer)은 다른 소화기암에 비해서 빈도가 낮으나, 예후가 좋지 않은 암으로 알려져 있다. 그러나 수술 기법의 발전, 수술 전후 항암치료의 발전 등에 힘입어 과거에 비하여 생존율이 증가하고 있다. 식도암을 전문적으로 치료하는 기관의 수도 많지 않아 식도암에 대해서 잘 알려져 있지 않으며, 이로 인해 진단 시 적극적인 치료를 꺼리는 경우들이 많다. 이에 식도암의 역학, 원인 및 수술 가능한 환자들에서의 수술적 치료 방법, 수술 후 후유증에 대해서 알아보고자 한다.
식도는 구강에서 위까지 음식을 전달하는 관 모양의 장기로 길이는 약 40 cm 정도이다. 식도 내강에서부터 점막층, 점막하층, 근육층으로 이루어져 있고, 근육층은 두 개의 층(inner circular, outer longitudinal)으로 나누어져 있으며, 근육층은 음식물이 아래로 내려갈 수 있도록 연동운동을 한다. 식도의 점막하층에는 림프관이 발달되어 있어 암세포가 점막하층까지 침범 시 이를 통해 암세포가 멀리 전이될 수 있다. 또한 식도는 다른 소화기관이 가지는 장막(serosa)이 없는 것이 특징적이다. 식도는 경부, 흉부, 복부에 걸쳐 위치하는데, 위치하는 부분에 따라 경부식도, 흉부식도, 복부 식도로 구분하여, 흉부 식도 내에서는 상부, 중부, 하부로 나누게 된다. 식도는 가슴 내에서 척추 앞, 기관지와 심장 뒤, 대동맥 옆, 양측 폐사이에 위치하여, 우리 몸 속에서 가장 깊은 곳에 존재한다. 식도의 양쪽 옆으로는 미주신경이 주행하며, 우측에서는 우측 쇄골하동맥, 좌측에서는 대동맥궁을 따라 되돌이 후두신경이 미주신경에서부터 분지하여 주행한다.
식도암은 식도의 내강에 접해 있는 층인 점막층에 있는 상피세포에서 암이 발생하는 것이 지칭한다. 점막층이 여러 carcinogen의 자극으로 인하여 원래 편평상피 점막세포에서부터 화생(metaplasia), 형성 이상(dysplasia) 등의 변화가 일어나게 되며, 이러한 자극이 누적이 되면 최종적으로 식도암이 발생하게 된다. 식도 점막에 가해지는 자극의 종류와 식도의 위치에 따라서 주로 발생하는 암의 종류가 다르다. 한국을 비롯한 중국 일본 등의 동아시아에서는 식도 상부와 중부에 편평상피세포암(esophageal squamous cell carcinoma)이 주로 발생하며, 한국의 경우도 2017년 통계에 따르면 전체 식도암의 약 91.2%가 편평상피세포암이다[1]. 편평상피세포암의 주된 원인으로는 흡연, 음주 등이 알려져 있다. 반면에 비만이 흔하여 위-식도 역류 환자가 많은 서구 국가에서는, 식도 하부에 편평상피세포가 위 점막세포로 변화하는 전암단계인 바렛식도가 흔히 관찰되며, 이후 식도선암(esophageal adenocarcinoma)으로 발전하게 된다. 이 두 질환은 단순히 병리학적 형태, 발생 기전과 호발 부위가 다른 것을 넘어서서, 병의 진행과 치료 방침에 있어서도 다르다는 점을 유념해야 한다(Table 1). 국내에서도 비만 인구가 늘어나고 서구화된 생활습관이 늘어남에 따라, 역류성 식도염, 바렛식도 및 식도선암 환자의 비율이 더 늘어날 것이라고 생각되나, 현재 국내 역학 연구상으로는 국내에서 바렛식도로 인한 식도선암의 발생 빈도는 증가하지 않고 있다[2]. 2017년 기준 국내 식도암 발생 중 식도선암은 3.1%로 보고되고 있다.
식도의 편평상피세포암 위험인자에 대한 역학 연구에 따르면, 흡연자는 비흡연자에 비해 식도 편평상피세포암이 발생률은 3.73배 증가하며[3], 음주를 하는 경우 금주를 하는 경우에 비해 3.3배 발생률이 증가한다[4]. 특히 알콜 대사 과정에서 생성되는 알데하이드(aldehyde)를 분해하는 aldehyde dehydrogenase2 (ALDH2) 효소의 유전자형 중 알데하이드 분해 능력이 떨어지는 사람들에서 식도 편평상피세포암이 호발한다는 연구결과는 이미 잘 알려져 있다[5]. 일본이나 중국은 한국에 비해서 인구대비 식도의 편평상피세포암 발생률이 더 높은데, 이는 뜨거운 차를 마시는 생활습관을 가지고 있는 것과 관련이 있을 것으로 생각된다. 실제로 연구에 따르면 뜨거운 차나 음식을 먹으면 식도암 발생률이 2.28배 증가한다고 알려져 있으며[6], 65도 이상의 뜨거운 음식은 2급 발암물질(동물 실험에서 발암물질로 입증됨)로 알려져 있다. 반면 야채와 과일을 골고루 섭취하면 식도의 편평상피세포암 발생률이 11% 가량 감소하는 것으로 보고되고 있다[7]. 즉 식도암을 예방하기 위해서는 음주와 흡연을 자제하고, 뜨거운 음식은 식혀서 섭취하며, 야채와 과일을 골고루 섭취하는 것이 중요하다.
식도암은 2020년 기준 전 세계에서 일곱 번째로 흔한 암이며, 암 관련 사망 원인 중 여섯 번째로 흔한 원인(연간 사망 544,000건), 암 관련 사망의 18분의 1을 차지한다[8]. 2017년에 한국에서 식도암은 모든 암 중 1.0%를 차지하는 2,483건이 진단되었고, 이는 한국에서 열다섯 번째로 흔한 암이자 암 관련 사망 원인 중 열한 번째로 흔한 원인이었다. 식도암의 조발생률은 10만 명당 4.8건(남성 8.8건, 여성 1.0건)이었고, 연령 표준화 발생률은 10만 명당 2.6건(남성 5.1건, 여성 0.5건)이었다[9]. 1999년과 2017년의 통계 자료를 비교해보면, 연령 표준화 발생률이 10만 명당 유의미하게 감소하였으며, 남녀 발생 비율은 10.2:1로 남성에서 빈번하게 발생하였다. 식도암은 60대 환자들 사이에서 가장 높은 유병률을 보였으며(33.7%), 그 다음으로 70대(29.8%)에서 흔히 발생하였다.
식도 자체가 근육층으로 이루어져 있어 잘 늘어나기 때문에, 식도암이 많이 진행되어야 증상이 발생하게 된다. 식사 시 연하 곤란, 가슴통증, 체중 감소 등이 진행된 병기에서 나타날 수 있고, 식도암이 되돌이 후두신경을 침범한 경우에는 쉰목소리가 나타날 수 있다. 국내에서는 검진 목적으로 시행하는 위내시경에서 초기 단계의 식도암을 발견하여 진단하는 경우들이 흔하다.
식도암이 의심되는 병변을 내시경으로 처음 관찰하게 되면, 조직검사를 하여 확진을 하고 세포형 및 분화도 등을 확인을 하게 된다. 더불어 내시경 초음파(endoscopic ultrasound)로 식도암이 식도의 어느 층까지 침범하였는지를 확인하게 된다. 또한 전이가 있는지 확인하기 위해서 흉부 및 복부 컴퓨터단층촬영(computed tomography), 그리고 전신 양성자단층촬영(positron emission tomography, PET)을 시행하게 된다. 일반적으로 전신 양성자단층촬영은 원격 전이 여부를 확인하기 위해 시행한다.
식도암의 병기는 다른 암종과 마찬가지로 TNM에 기반한 병기를 사용한다. 원발 병변의 진행정도(T), 주변 림프절의 전이 여부(N), 그리고 원격 전이가 발생하였는지 여부(M)로 식도암의 진행상태를 기술하며, 이를 병기에 적용한다. 현재 사용하는 식도암의 병기 시스템은 2016년도에 발표된 American Joint Committee on Cancer (AJCC) 8판을 기준으로 하고 있으며[10], 이는 Worldwide Esophageal Cancer Collaboration (WECC)이라는 조직에 의해서 제안되었다. AJCC 8판 식도암 병기가 다른 암종의 병기와 달리 특이한 점은, 식도의 편평상피세포암과 선암의 병기를 분리하였고, 임상병기(clinical stage), 수술 전 치료를 시행하지 않은 병리 병기(pathologic stage), 수술 전 치료를 시행한 병리 병기(ypStage)로 구분하여, 총 5개의 stage grouping이 존재한다는 것이다. 이러한 복잡한 구성은 임상의로서 병기 시스템을 사용하기 어렵게 만들며, 이후 시행된 검증 연구들에서 AJCC 8판 병기가 환자의 생존율을 잘 예측하지 못한다는 보고들이 있어, AJCC 8판 병기가 널리 사용되는 데 한계점으로 작용하고 있다. 이와 더불어 일본에서는 자체적인 식도암 병기가 있으며, 현재 2017년에 발표된 11판 식도암 병기를 자체적으로 사용하고 있다[11]. 일본의 병기 시스템은 AJCC와 달리 하나의 stage grouping만을 제시하고 있다. 또한 AJCC는 N factor를 전이된 림프절 숫자로 정의하나, 일본 병기 시스템에서는 림프절 전이의 정도(extent)를 기준으로 하는 등의 차이점이 있다. 2024년에는 AJCC 9판과 일본 식도암 병기 12판이 발표될 예정으로, 식도암 병기에 있어서 변화가 있을 것으로 예상된다.
개략적은 식도암의 진단과 치료는 Figure 1에 정리하였다. 다른 암종과 마찬가지로 식도암도 진단 과정에서 산출된 임상병기에 따라서 치료 방침을 결정하게 된다. 수술 전 검사를 통해서 림프절 혹은 원격 전이가 없고, 식도의 점막층에만 암세포가 존재하고, 그 범위가 넓지 않다면, 내시경적으로 암세포가 존재하는 점막층만 절제하는 내시경 절제술을 먼저 시행하게 된다. 식도절제술 후에는 필연적으로 삶의 질 저하가 발생하므로, 내시경적으로 완전 절제가 기술적으로 가능하다면 시도하는 것이 종양학적, 그리고 이후 삶의 질에 있어서도 좋은 선택이다. 내시경적 절제 후 병변을 현미경을 관찰하여, 완전 절제가 되었고 림프절 전이의 가능성이 높지 않다고 판단이 된다면 추가 치료를 하지 않고 추적 관찰을 하나, 완전 절제가 되지 않았거나, 림프절 전이의 가능성이 높은 병리적 소견이 관찰된다면 추가로 수술적 치료 혹은 방사선 치료를 시행하게 된다.
암세포가 점막하층에만 존재하여 병변의 범위가 넓어 내시경적으로 절제가 어렵다고 판단되는 경우, 절제 후 협착 등의 합병증이 생길 가능성이 높다 생각되는 경우, 암세포가 점막하층 이상 침범한 경우, 또는 림프절 전이 혹은 원격전이가 동반되고 있지 않은 경우 등에서는 바로 수술적 절제를 시행한다. 그리고 수술적 절제 후 최종 병리 결과 상에서 림프절 전이가 발견된다면 추가로 항암치료를 시행하게 된다. 환자가 수술을 견디지 못하는 상태라 판단되면 수술적 치료 대신 치료 목적의 방사선 치료 혹은 항암방사선 병용 요법을 시도할 수 있다.
수술 전 검사에서 림프절 전이가 발견되거나, 병변이 근육층 이상 침범한 경우에는 일반적으로 수술 전 치료를 먼저 시행한 후 수술을 하게 된다. 네덜란드에서 시행된 CROSS trial에서는 carboplatin와 paclitaxel 항암치료와 41.4 Gy의 방사선 치료를 시행 후 수술을 시행한 군에서 바로 수술을 한 군에 비하여 월등한 생존율 향상을 보고하였으며[12], 이 결과를 통하여 현재 수술 전 치료를 항암방사선치료가 표준치료로 받아들여지고 있다. 반면 일본에서는 Japan Clinical Oncology Group (JCOG) 9907 trial의 결과를 바탕으로 cisplatin과 5-fluorouracil 항암치료 후 수술을 시행하는 치료가 표준으로 받아들여지고 있다[13]. 수술 전 치료를 시행할 경우, 영상검사에서 발견되지 못하는 미세한 전이를 미리 제거할 수 있으며, 완전 절제의 가능성을 높여 생존율을 향상시킨다는 연구결과들이 많이 보고되고 있다. 그러나 수술 전 치료 과정에서 오히려 식도암이 진행되거나, 항암 혹은 항암방사선으로 인하여 환자가 컨디션이 악화되어 수술을 받지 못하게 될 가능성이 있다는 점도 염두에 두어야 한다. cT2N0의 경우는 림프절 전이가 없는 국소 진행 식도암이어서, 수술을 바로 하는 것과 수술 전 치료 후 수술을 시행하는 방안 모두 적용이 가능하며, National Comprehensive Cancer Network 가이드라인에서는 병변의 크기가 3 cm 이상, 분화도가 좋지 않은 경우, 혈관 침윤이 동반된 경우는 수술 전 치료 여부를 결정할 것을 권장하고 있다.
위의 경우들은 환자가 의학적으로 수술을 견딜 수 있을 것이라 판단되는 경우이며, 환자가 식도절제술을 견디지 못할 것이라 판단되는 경우는 환자의 임상병기에 따라 치료 목적의 항암방사선 요법, 혹은 항암치료를 시행하게 된다. 의학적으로 수술을 견딜 수 있을지에 대한 명확한 기준은 없으나, 일반적으로 나이, 전신 상태, 동반 질환, 기저 폐질환, 과거 수술력 등을 주로 고려하게 된다.
식도암 수술은 암 관련 수술 중 가장 사망률이 높고, 합병증 발생률도 높은 고난이도의 수술로 알려져 있다. 또한 경부, 흉부, 복부에 걸쳐서 넓은 영역을 수술해야 하기 때문에 외과의사의 숙련도와 경험이 매우 중요하다. 식도암 수술을 크게 3가지로 나눌 수 있는데, 식도절제술+림프절 절제술+재건술이다. 식도절제술은 경부, 흉부, 복부에 걸쳐 있는 긴 식도를 모두 제거하는 것이다. 식도의 점막하층에는 미세한 림프관들이 존재하여, 이를 통해 암세포가 멀리까지 전이될 수 있어, 암이 식도의 일부에만 존재하더라도 식도를 모두 절제하는 것이 원칙이며, 일부 절제 후 단단 문합(end-toend anastomosis)은 시행하지 않는다. 또한 식도암은 주변의 림프절로 전이가 많이 일어나서, 주변의 림프절을 깨끗하게 모두 제거하는 것이 매우 중요하다. 식도암 수술 시 제거된 림프절의 숫자가 생존율과 관련이 있다는 결과는 많은 문헌들을 통해 반복적으로 보고되고 있다. 그러나 박리된 림프절의 숫자 뿐만 아니라, 전이가 호발하는 부위의 림프절은 반드시 제거하여야 한다. 특히 식도 편평상피세포암의 경우는 식도 상부 주변의 림프절, 특히 양측 되돌이 후두신경 주변으로 림프절 전이가 많이 발생하기 때문에, 이 부위의 림프절을 깨끗하게 제거해야 한다고 알려져 있다. 또한 식도암의 위치가 상부이거나, 수술 전 검사에서 목 부위에 전이가 의심이 되는 경우는, 경부의 림프절도 모두 제거해야 한다. 일본에서는 병변의 위치와 무관하여 경부, 흉부, 복부의 모든 림프절을 절제하는 3-field lymph node dissection을 원칙으로 하나[14], 반면에 중, 하부 식도암에서는 경부에 림프절 전이가 없을 경우 흉부와 복부의 림프절만 제거하는 2-field lymph node dissection만 시행해도 3-field lymph node dissection을 시행한 경우와 생존율에 차이가 없다는 무작위대조시험 연구결과들도 보고되고 있고[15], 일반적으로 3-field lymph node dissection이 합병증을 유발할 가능성이 높기 때문에, 적절한 림프절 절제술의 범위에 대해서는 아직도 논란이 있다.
식도와 주변 림프절을 제거하고 나면, 식도를 대신할 장기를 사용하여 재건을 해야 한다. 복부에서 경부 혹은 흉부의 맨 윗부분까지 약 35-40 cm 이상의 거리를 재건해야 하는데, 주로 위를 사용하며, 혹은 대장이나 소장을 사용하여 경부 혹은 흉부의 가장 높은 부위에서 식도와 문합하는 방식으로 재건을 하게 된다.
식도암 수술 후 합병증 발생률은 통상 50% 이상이며, 사망률 또한 3% 이상으로 알려져 있다[16]. 이는 식도암 수술을 받은 환자의 절반이 경증에서 중증의 합병증이 발생한다는 의미이다. 국내에서 심평원이 발표한 2012년도 진료량 평가 결과보고서 자료에 따르면, 국내에서 식도암 수술 후 사망률은 4.68%로 보고되어 있고, 이는 해외의 자료와 유사한 수치이다. 수술 후 주로 발생하는 합병증은 폐렴, 성대신경마비(되돌이 후두신경 마비), 문합 부위 누출 등이 있으며, 폐렴은 가장 흔한 합병증으로 약 10%에서 발생한다고 보고되고 있고 식도암 수술 후 사망도 대부분이 이 폐렴과 관련이 있다[17]. 성대신경마비는 식도 편평상피세포암이 가장 흔하게 전이되는 되돌이 후두신경 주변의 림프절 박리 과정에서 발생하며, 약 30% 정도에서 발생한다. 성대신경마비는 되돌이 후두신경 주변의 림프절 박리 과정에서 신경이 당겨지거나 손상을 받아 발생하며, 기술적으로 숙련된 외과의가 집도하더라도 필연적으로 발생할 수 있다. 되돌이 후두신경이 완전이 손상을 받은 경우가 아니라면 수술 후 추적관찰 기간 중에 성대신경마비가 돌아오는 경우가 대부분이나, 지속적으로 성대신경손상과 목소리 마비가 후유증으로 남을 수 있다. 문합 부위 누출은 식도 절제 부위와 위 등의 재건 장기 사이의 문합 부위가 제대로 아물지 않고 벌어지는 것을 의미하며, 수술 방법과 문합 부위에 따라 발생률이 다르게 보고되지만, 약 1-10%에서 발생하게 된다[18]. 그리고 수술 직후에는 나타나지 않아도, 수술 후 수개월 혹은 수 년 이후에는 문합 부위 협착이 발생할 수도 있다.
예전에는 식도암 수술을 하기 위해서 개흉, 개복을 하였기 때문에 수술이 매우 크고, 합병증도 많이 발생하였지만, 최근에는 로봇이나 흉강경, 복강경을 사용하는 최소침습수술이 많이 시행되고 있다. 최소침습수술을 시행할 경우 절개가 작아지고, 그로 인해 환자에게 가해지는 손상이 적어지므로 회복이 빠르고 합병증이 적게 일어날 수 있으며, 특히 폐렴 등의 호흡기계 합병증을 유의하게 줄어든다고 되어 있다. 하지만 식도암 수술에 있어서 최소침습수술은 기술적으로 매우 까다롭고 배우기 어렵기 때문에 숙련된 외과의사에 의해서 시행되는 것이 중요하다. 그리고 수술 방법은 수술의 목적 그 자체가 될 수 없으며, 완전 절제 자체가 수술의 목적이 되어야 한다. 수술 방법은 환자의 상태, 병변의 크기 등을 종합적으로 판단하여 집도의가 최선의 방법을 선택해야 한다.
식도를 절제하고 위를 사용하여 재건을 할 경우, 위가 가지는 음식 저장 가능이 사라지기 때문에, 환자는 생활습관을 바꾸어야 한다. 한 번에 많은 양의 식사를 할 수 없으며 예전의 식사 섭취량의 1/2-1/3을 하루에 6-8번 나누어서 식사를 해야 한다. 또한 정상적으로 식도와 위 사이에 존재하는 역류를 막는 해부학적 구조물들이 사라지기 때문에 항상 위의 내용물들이 역류가 될 수 있다는 점을 주의해야 한다. 늦은 시간에 식사를 하고 취침하는 것은 역류로 인한 흡인성 폐렴의 위험성이 매우 높다. 또한 위가 식도와는 달리 연동운동을 하지 않기 때문에, 중력에 의해서 내용물이 내려가는 것을 기다려야 한다. 이러한 변화들로 인하여 환자의 삶의 질이 많이 떨어지는 것이 현재 식도암 수술이 가지는 문제점이다. 평균적으로 수술 직후 환자의 삶의 질이 가장 떨어지고, 그 후 서서히 회복되나 2년 후에도 수술 전의 삶의 질로 돌아가지 않는다[19]. 그러나 삶의 질 문제에 있어서는 환자가 새로운 생리 상태에 잘 적응하여 생활 습관을 교정하는 것이 매우 중요하다.
삶의 질 문제 뿐만 아니라 수술 후 영양문제도 식도암 환자들에게 중요하다. 섭취량이 줄기 때문에 거의 대부분의 환자들이 수술 후 몸무게가 감소하는 현상을 보이는데, 수술 후 절반 이상의 환자들이 수술 후 1년째 10% 이상의 체중감소를 보인다[20]. 이러한 수술 후 체중 감소는 장기 생존과도 관련이 있다는 보고들이 있으며, 따라서 체중이 감소되는 것을 막기 위해 노력해야 한다. 식도암 수술 후 암의 재발을 막는 음식은 없으나, 환자가 만성적인 영양부족 상태이며, 수술로 인하여 많은 양의 식사를 할 수 없기 때문에 고단백 고지방 위주의 식사를 하는 것이 권장된다.
식도암의 초기에 발견되어 내시경적 절제술로 완전 절제가 가능하거나, 림프절 전이가 없는 1기 식도암의 경우 완전 절제 후 높은 생존율을 기대할 수 있다. AJCC 8판 병기에 사용된 WECC의 자료를 보면, pStage IA의 식도암의 경우 5년 생존율은 80% 로 보고되고 있다[21]. 그러나 수술 후 림프절 전이가 발견되는 경우, 수술 전 치료가 필요했던 국소 진행 식도암의 경우는 아직 치료 성적이 만족스럽지 못하다. AJCC 8판 자료에서 수술 전 치료를 받고 수술을 시행한 ypStage I 및 ypStage II에 있는 환자들의 5년 생존율은 각각 50%와 30% 내외로 보고되고 있다[22]. 이는 식도암 치료에 있어서 조기 발견과 치료의 중요성을 의미한다고 볼 수 있다. 또한 국소 진행 식도암의 경우 기존의 수술 전 항암방사선 혹은 항암치료보다 더 효과적인 약제와 방법이 필요함을 시사한다.
면역관문억제제를 사용한 면역치료는 최근 모든 암종에서 각광을 받는 치료이다. 식도암에서는 수술이 불가능한 재발 혹은 4기 전이성 식도암에서 면역관문억제제 사용의 가능성이 연구되어 왔다. 2021년에는 수술 전 항암방사선 치료 후 수술을 시행한 환자에서 보조 치료 adjuvant therapy로서 면역관문억제제인 nivolumab을 사용시 무병 생존율이 증가한다는 checkmate 577 연구결과가 발표되었다[23]. 현재 한국에서는 수술 후 보조 항암치료로서 면역관문억제제는 승인되었으나, 아직 보험 적용이 되지 않아 경제적인 이유로 사용에 제한이 있다. 면역관문억제제의 적응증을 넓혀 수술 전 치료에도 적용하려는 연구들이 활발하게 진행되고 있으나 현재까지의 결과는 phase II clinical trial들의 결과이며, 현재 진행 중인 phase III trial의 결과가 기대된다.
식도암은 다른 암종에 비해서 여전히 예후가 좋지 않고, 수술적 치료 후 높은 합병증 발생률과 사망률로 인하여 적극적인 치료를 꺼리는 경우가 많지만 수술을 포함한 항암, 방사선의 다양한 치료 방법을 적극적으로 활용 시 완치를 기대해볼 수 있다. 수술 또한 기존의 고식적인 개흉술에서 최소침습수술이 도입되면서 치명적인 합병증 발생률 또한 줄어들고 있다. 항암치료 또한 기존의 백금제재 항암제에서, 최근에는 면역관문억제제까지 다양하게 시도되고 있어, 식도암의 치료 성적은 더 좋아질 것이라 기대한다. 무엇보다 조기 진단과 적극적인 치료가 매우 중요하기 때문에 위내시경을 정기적으로 시행하고, 술, 담배 등의 식도암 발생 원인을 생활 속에서 차단하는 것이 매우 중요하다.
Acknowledgement
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea government (Ministry of Science and ICT; No.2022R1A2C209310611).
Figure 1.
Treatment algorithms of esophageal squamous cell carcinoma. EUS, endoscopic ultrasound; CT, computed tomography; PET, positron emission tomography.
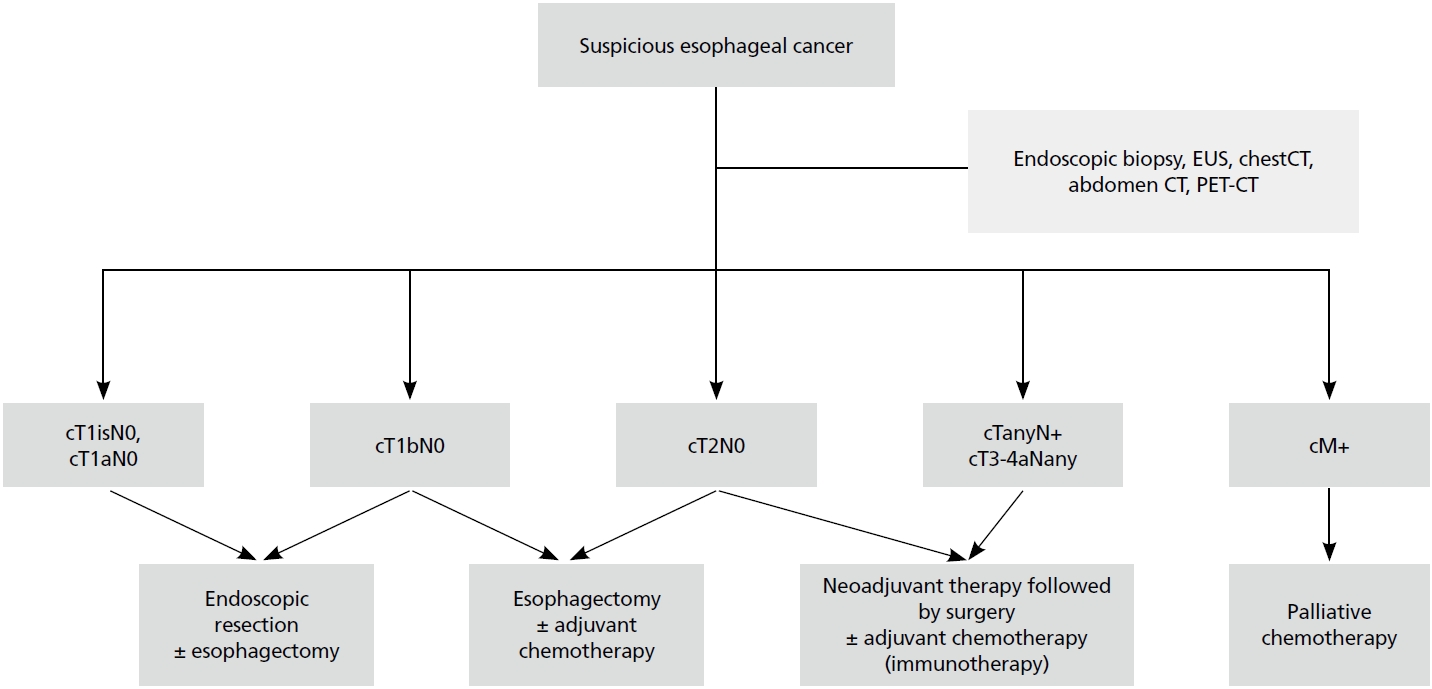
Table 1.
Comparison of esophageal squamous cell carcinoma and esophageal adenocarcinoma
References
1. Hong S, Won YJ, Park YR, et al. Cancer statistics in Korea: incidence, mortality, survival, and prevalence in 2017. Cancer Res Treat 2020;52:335-350.




2. Kim JJ. Epidemiology of gastroesophageal junction adenocarcinoma in Korea. J Gastric Cancer 2018;18:328-338.




3. Oze I, Matsuo K, Ito H, et al. Cigarette smoking and esophageal cancer risk: an evaluation based on a systematic review of epidemiologic evidence among the Japanese population. Jpn J Clin Oncol 2012;42:63-73.


4. Oze I, Matsuo K, Wakai K, et al. Alcohol drinking and esophageal cancer risk: an evaluation based on a systematic review of epidemiologic evidence among the Japanese population. Jpn J Clin Oncol 2011;41:677-692.


5. Lewis SJ, Smith GD. Alcohol, ALDH2, and esophageal cancer: a meta-analysis which illustrates the potentials and limitations of a Mendelian randomization approach. Cancer Epidemiol Biomarkers Prev 2005;14:1967-1971.



6. Andrici J, Eslick GD. Hot food and beverage consumption and the risk of esophageal cancer: a meta-analysis. Am J Prev Med 2015;49:952-960.

7. Yamaji T, Inoue M, Sasazuki S, et al. Fruit and vegetable consumption and squamous cell carcinoma of the esophagus in Japan: the JPHC study. Int J Cancer 2008;123:1935-1940.


8. Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021;71:209-249.



9. Park SY, Kim DJ. Esophageal cancer in Korea: epidemiology and treatment patterns. J Chest Surg 2021;54:454-459.



10. Rice TW, Patil DT, Blackstone EH. 8th edition AJCC/UICC staging of cancers of the esophagus and esophagogastric junction: application to clinical practice. Ann Cardiothorac Surg 2017;6:119-130.



11. Japan Esophageal Society. Japanese Classification of Esophageal Cancer, 11th Edition: part I. Esophagus 2017;14:1-36.



12. van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 2012;366:2074-2084.


13. Ando N, Kato H, Igaki H, et al. A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol 2012;19:68-74.



14. Udagawa H. Past, present, and future of three-field lymphadenectomy for thoracic esophageal cancer. Ann Gastroenterol Surg 2020;4:324-330.




15. Li B, Zhang Y, Miao L, et al. Esophagectomy with three-field versus two-field lymphadenectomy for middle and lower thoracic esophageal cancer: long-term outcomes of a randomized clinical trial. J Thorac Oncol 2021;16:310-317.


16. Takeuchi H, Miyata H, Gotoh M, et al. A risk model for esophagectomy using data of 5354 patients included in a Japanese nationwide web-based database. Ann Surg 2014;260:259-266.


17. Atkins BZ, Shah AS, Hutcheson KA, et al. Reducing hospital morbidity and mortality following esophagectomy. Ann Thorac Surg 2004;78:1170-1176.


19. Park SY, Jung I, Heo SJ, Byun GE, Lee EY, Kim DJ. Comparison of QoL between substernal and posterior mediastinal routes in esophagogastrostomy. J Gastrointest Surg 2021;25:635-640.



20. Park SY, Kim DJ, Suh JW, Byun GE. Risk factors for weight loss 1 year after esophagectomy and gastric pull-up for esophageal cancer. J Gastrointest Surg 2018;22:1137-1143.



21. Rice TW, Ishwaran H, Hofstetter WL, et al. Recommendations for pathologic staging (pTNM) of cancer of the esophagus and esophagogastric junction for the 8th edition AJCC/UICC staging manuals. Dis Esophagus 2016;29:897-905.



Peer Reviewers’ Commentary
이 논문은 예후가 좋지 않은 대표적 암종 중 하나인 식도암의 역학, 원인, 수술을 포함한 치료 방법과 수술 후 후유증까지 식도암에 대한 전반적인 내용을 잘 정리한 논문이다. 국내의 식도암은 서구와는 다른 양상의 병인을 보이기 때문에 그에 따라 치료 계획의 접근법도 달라져야 한다. 수술 방법에 있어서는 예전의 개흉, 개복 수술을 벗어나 흉강경, 복강경 또는 로봇을 이용한 최소 침술 수술이 점차 일반화되면서 환자의 회복이 빨라지고 합병증 발생률도 많이 감소하고 있다. 그러나, 여전히 진행된 병기의 식도암 치료 성적이 좋지 않은 상황에서는 면역관문억제제 사용으로 식도암의 치료 성적을 크게 향상시킬 수 있음을 잘 설명해 주고 있다. 이 논문은 식도암 환자를 진료하는 임상 현장에 많은 도움이 될 것으로 판단된다.
[정리: 편집위원회]
-
METRICS

-
- 0 Crossref
- Scopus
- 766 View
- 146 Download
-
Related articles in
J Korean Med Assoc -
Endoscopic treatment of colorectal polyps and early colorectal cancer2023 November;66(11)
Diagnosis and treatment of dysphagia2023 October;66(10)
Pharmacological treatment of Ménière disease2023 October;66(10)
Diagnosis and treatment of adult spinal deformity2023 August;66(8)
Surgical treatment of knee osteoarthritis focusing on the patellofemoral joint2023 August;66(8)






